Oct
22
¡¡DEBATE!! Sobre las estrellas y lo que suponen en el conjunto del...
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Debates ~
Clasificado en Debates ~
 Comments (23)
Comments (23)
LAS ESTRELLAS:
Que por cierto, son algo más, mucho más, que simples puntitos luminosos que brillan en la oscuridad de la noche. Una estrella es una gran bola de gas luminosa que, en alguna etapa de su vida, produce energía por la fusión nuclear del hidrógeno para formar helio. El término estrella por tanto, no sólo incluye estrellas como nuestro Sol, que están en la actualidad quemando hidrógeno, sino también protoestrellas, aún no lo suficientemente calientes como para que dicha combustión haya comenzado, y varios tipos de objetos evolucionados como estrellas gigantes y supergigantes, que están quemando otros combustibles nucleares, o las enanas blancas y las estrellas nucleares, que están formadas por combustible nuclear gastado.

La masa máxima de una estrella es de unas 125 masas solares, por encima de la cual sería destruida por su propia radiación. La masa mínima es de 0,08 masas solares; por debajo de ella, los objetos no serían lo suficientemente calientes en sus núcleos como para que comience la combustión del hidrógeno, y se convertirían en enanas marrones.
La luminosidad de las estrellas varían desde alrededor de medio millón la luminosidad del Sol para las más calientes hasta menos de una milésima de la del Sol para enanas más débiles.

Aunque las estrellas más prominentes visibles a simple vista son más luminosas que el Sol, la mayoría de las estrellas son en realidad más débiles que éste y, por tanto, imperceptibles a simple vista.
Las estrellas brillan como resultado de la conversión de masa en energía por medio de reacciones nucleares, siendo las más importantes las que involucran al hidrógeno.
Oct
22
¡La Mecánica Cuántica!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Sin categoría ~
Clasificado en Sin categoría ~
 Comments (4)
Comments (4)
¡La Física! Esa maravilla

Las sustancias formadas por una sola clase de átomos se llaman elementos químicos. La palabra “átomo” procede del griego ατομος, que significa “indivisible” y el uso de la palabra “elemento” sugiere que se ha llegado a los ladrillos básicos con los que está formada la materia. De hecho, esta es la imagen que se tenía a mediados del siglo XIX cuando se acuñaron estos términos. Sin embargo, hoy sabemos que todo esto es falso, que los átomos se pueden dividir y que, de esta manera, los elementos han dejado de ser verdaderamente elementales. Los físicos continúan con esta nomenclatura aunque sea formalmente incorrecta, ya que, la costumbre, como dicen los juristas, no pocas veces rigen la jerga de las leyes.

La observación más precisa del electrón revela que es esférico como predice el Modelo Estándar de la Física
A todo esto y hablando de los átomos, por fuerza, nos tenemos que acordar del electrón que da al átomo su forma esférica. Son partículas cargadas eléctricamente que se mueven alegremente alrededor del núcleo. El electrón es muy ligero: su masa es solamente 1/1.8836 de la del núcleo más ligero (el hidrógeno). La carga eléctrica del electrón es de signo opuesto a la del núcleo, de manera que los electrones están fuertemente atraídos hacia el núcleo y se repelen mutuamente. Si la carga eléctrica total de los electrones en un átomo iguala a la del núcleo, para lo que generalmente se necesitan varios electrones, se dice que el átomo está en equilibrio o que es eléctricamente neutro.

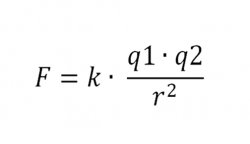
La fuerza a la que obedecen los electrones, la denominada fuerza electrostática o de Coulomb, es matemáticamente bastante sencilla y, sin embargo, los electrones son los responsables de las importantes propiedades de los “enlaces químicos”. Esto se debe a que las leyes de movimiento de los electrones están regidas completamente por la “mecánica cuántica”, teoría que se completó a principios del siglo XX. Es una teoría paradójica y difícil de entender y explicar, pero al mismo tiempo es muy interesante, fantástica y revolucionaria. Cuando uno se introduce en las maravillas de la mecánica cuántica es como si hiciera un viaje a un universo que está situado fuera de este mundo nuestro, ya que, las cosas que allí se ven, desdicen todo lo que dicta nuestro sentido común de cómo tiene que ser el mundo que nos rodea.

No solamente los electrones, sino también los núcleos atómicos y los átomos en su conjunto obedecen y se rigen por la mecánica cuántica. La Física del siglo XX empezó exactamente en el año 1900, cuando el físico alemán Max Planck, escribió un artículo de ocho páginas y allí propuso una posible solución a un problema que había estado intrigando a los físicos durante años. Es el problema de la luz que emiten los cuerpos calentados a una cierta temperatura, y también la radiación infrarroja emitida, con menos intensidad, por los objetos más fríos.



Estaban bien aceptados entonces que esta radiación tenía un origen electromagnético y que se conocían las leyes de la naturaleza que regían estas ondas electromagnéticas. También se conocían las leyes para el frío y el calor, la así llamada “termodinámica”, o al menos eso parecía. Pero si usamos las leyes de la termodinámica para calcular la intensidad de la radiación, el resultado no tiene ningún sentido. Los cálculos nos dicen que se emitiría una cantidad infinita de radiación en el ultravioleta más lejano, y, desde luego, esto no es lo que sucede. Lo que se observa es que la intensidad de la radiación muestra un pico a una cierta longitud de onda característica, y que la intensidad disminuye tanto para las longitudes mayores como para las longitudes menores. Esta longitud característica es inversamente proporcional a la temperatura absoluta del objeto radiante (la temperatura absoluta se define por una escala de temperatura que empieza a 273 ºC bajo cero). Cuando a 1.000 ºC un objeto se pone al “rojo vivo”, el objeto está radiando en la zona de luz visible.
Lo que Planck propuso fue simplemente que la radiación sólo podía ser emitida en paquetes de un tamaño dado. La cantidad de energía de uno de esos paquetes, o cuantos, es inversamente proporcional a la longitud de la onda y, por lo tanto, proporcional a la frecuencia de la radiación emitida. La sencilla fórmula es:
E = h x v

Cuando Planck calculó la intensidad de la radiación térmica imponiendo esta nueva condición, el resultado coincidió perfectamente con las observaciones.

Aunque la Teoría de la Relatividad fue un gran hito en su carrera, Albert Einstein no recibió el Nobel por ella, sino por la explicación del efecto fotoeléctrico. Einstein fue galardonado con el Nobel en 1921 por dar explicación al efecto fotoeléctrico. En la imagen, Einstein rodeado por reporteros ese mismo año.
Poco tiempo después, en 1905, Einstein formuló esta teoría de una forma mucho más tajante: el sugirió que los objetos calientes no son los únicos que emiten radiación en paquetes de energía, sino que toda la radiación consiste en múltiplos de los paquetes de energía de Planck. El príncipe francés Louis-Victor de Broglie, dándole otra vuelta a la teoría, propuso que no sólo cualquier cosa que oscila tiene una energía, sino que cualquier cosa con energía se debe comportar como una “onda” que se extiende en una cierta región del espacio, y que la frecuencia, v, de la oscilación verifica la ecuación de Planck. Por lo tanto, los cuantos asociados con los rayos de luz deberían verse como una clase de partículas elementales: el fotón. Todas las demás clases de partículas llevan asociadas diferentes ondas oscilatorias de campos de fuerza.

El curioso comportamiento de los electrones en el interior del átomo, descubierto y explicado por el famoso físico danés Niels Bohr, se pudo atribuir a las ondas de De Broglie. Poco después, en 1926, Erwin Schrödinger descubrió como escribir la teoría ondulatoria de Debroglie con ecuaciones matemáticas exactas. La precisión con la cual se podían realizar cálculos era asombrosa, y pronto quedó claro que el comportamiento de todos los objetos pequeños estaban exactamente determinados por la recién descubiertas “ecuaciones de onda cuánticas”.


Pocas dudas nos pueden caber a estas alturas de que la mecánica cuántica (de Planck) y, la Relatividad –tanto especial como general- (de Einstein), además de ser las dos teorías más importantes de la Física de nuestro tiempo, funcionan de tal forma que uno, cuando profundiza en sus predicciones y las compara con lo que ocurre en el Universo, no puede por menos que, asombrarse, al comprobar como unas mentes humanas han sido capaces de llegar a estos profundos pensamientos que nos acerca a la realidad de la Naturaleza.
Emilio Silvera Vázquez
Oct
22
El universo de lo muy pequeño
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (0)
Comments (0)
“Adentrarse en el universo de las partículas que componen los elementos de la tabla periódica, y en definitiva, la materia conocida, es verdaderamente fantástico”.
Tan pronto como los Joliot-Curie crearon el primer isótopo radiactivo artificial, los físicos se lanzaron en tropel a producir tribus enteras de ellas. En realidad, las variedades radiactivas de cada elemento en la tabla periódica son producto de laboratorio. En la moderna tabla periódica, cada elemento es una familia con miembros estables e inestables, algunos procedentes de la naturaleza, otros sólo del laboratorio. Por ejemplo, el hidrógeno presenta tres variedades: en primer lugar, el corriente, que tienen un solo protón. En 1932, el químico Harold Urey logró aislar el segundo. Lo consiguió sometiendo a lenta evaporación una gran cantidad de agua, de acuerdo con la teoría de que los residuos representarían una concentración de la forma más pesada del hidrógeno que se conocía, y, en efecto, cuando se examinaron al espectroscopio las últimas gotas de agua no evaporadas, se descubrió en el espectro una leve línea cuya posición matemática revelaba la presencia de hidrógeno pesado.

El núcleo de hidrógeno pesado está constituido por un protón y un neutrón. Como tiene un número másico de 2, el isótopo es hidrógeno. Urey llamó a este átomo deuterio (de la voz griega deutoros, “segundo”), y el núcleo deuterón. Una molécula de agua que contenga deuterio se denomina agua pesada, que tiene puntos de ebullición y congelación superiores al agua ordinaria, ya que la masa del deuterio es dos veces mayor que la del hidrógeno corriente. Mientras que ésta hierve a 100º C y se congela a 0º C, el agua pesada hierve a 101’42º C y se congela a 3’79º C. El punto de ebullición del deuterio es de -23’7º K, frente a los 20’4º K del hidrógeno corriente. El deuterio se presenta en la naturaleza en la proporción de una parte por cada 6.000 partes de hidrógeno corriente. En 1934 se otorgó a Urey el premio Nobel de Química por su descubrimiento del deuterio. El deuterio resultó ser una partícula muy valiosa para bombardear los núcleos. En 1934, el físico australiano Marcus Lawrence Edwin Oliphant y el austriaco P. Harteck atacaron el deuterio con deuterones y produjeron una tercera forma de hidrógeno, constituido por un protón y dos neutrones. La reacción se planteó así:
El deuterio resultó ser una partícula muy valiosa para bombardear los núcleos. En 1934, el físico australiano Marcus Lawrence Edwin Oliphant y el austriaco P. Harteck atacaron el deuterio con deuterones y produjeron una tercera forma de hidrógeno, constituido por un protón y dos neutrones. La reacción se planteó así:

hidrógeno 2 + hidrógeno 2 = hidrógeno 3 + hidrógeno 1
Este nuevo hidrógeno superpesado se denominó tritio (del griego tritos, “tercero”); su ebullición a 25º K y su fusión a 20’5º K.
















 Totales: 77.776.747
Totales: 77.776.747 Conectados: 72
Conectados: 72























