Mar
10
Todo es Universo… ¡También nosotros!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El Universo asombroso ~
Clasificado en El Universo asombroso ~
 Comments (2)
Comments (2)
Recordemos la Misión Cassini Huygens
Sobrevuelos a Venus, la Tierra y Júpiter
 La masa de la sonda Cassini es tan grande que no fue posible emplear un vehículo de lanzamiento que la dirigiese directamente a Saturno. Para alcanzar este planeta fueron necesarias cuatro asistencias gravitacionales; de esta forma, Cassini empleó una trayectoria interplanetaria que la llevaría a Venus en dos ocasiones, posteriormente hacia la Tierra y después hacia Júpiter. Después de sobrevolar Venus en dos ocasiones a una altitud de 284 Km, el 26 de abril de 1998 y a 600 Km, el 24 de junio de 1999, el vehículo se aproximó a la Tierra, acercándose a 1171 Km de su superficie el 18 de agosto de 1999. Gracias a estas tres asistencias gravitacionales, Cassini adquirió el momento suficiente para dirigirse al Sistema Solar externo. La cuarta y última asistencia se llevaría a cabo en Júpiter, el 30 de diciembre de 2000, sobrevolándolo a una distancia de 9.723.890 Km, e impulsándose hacia Saturno.
La masa de la sonda Cassini es tan grande que no fue posible emplear un vehículo de lanzamiento que la dirigiese directamente a Saturno. Para alcanzar este planeta fueron necesarias cuatro asistencias gravitacionales; de esta forma, Cassini empleó una trayectoria interplanetaria que la llevaría a Venus en dos ocasiones, posteriormente hacia la Tierra y después hacia Júpiter. Después de sobrevolar Venus en dos ocasiones a una altitud de 284 Km, el 26 de abril de 1998 y a 600 Km, el 24 de junio de 1999, el vehículo se aproximó a la Tierra, acercándose a 1171 Km de su superficie el 18 de agosto de 1999. Gracias a estas tres asistencias gravitacionales, Cassini adquirió el momento suficiente para dirigirse al Sistema Solar externo. La cuarta y última asistencia se llevaría a cabo en Júpiter, el 30 de diciembre de 2000, sobrevolándolo a una distancia de 9.723.890 Km, e impulsándose hacia Saturno.
¿Que es el núcleo atómico? ¿Cómo en un objeto tan pequeño pueden pasar tantas cosas?
El propio Rutherford empezó a vislumbrar la respuesta a la pregunta que arriba hacemos. Entre 1.906 y 1.908 (hace más de un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos. Algunas de aquellas partículas no aparecían por ninguna parte, parecían que chocaban con algo sólido… ¿Qué sería?

Pero centrémonos en el trabajo que aquí se expone que se anuncia arriba como: Todo es Universo… ¡También nosotros!
El Universo lo es todo. El Espacio y el Tiempo, la Materia y las fuerzas que con ella interaccionan, las Constantes de la Naturaleza y todo ello, implica una serie de cuestiones de una complejidad inmensa que aún, no hemos podido resolver. La cantidad de teorías, de modelos, de experimentos y de posibilidades que están en marcha en los distintos campos del saber, son enormes, y, finalmente, todas deberán ser unidas en un solo y complementado conocimiento que nos lleve a ese entendimiento profundo de nuestro Universo como un todo que es, lo que podremos ver, trás unir las piuezas del rompecabezas con el que ahora estamos trabajando al dilucidar parcelas de esa inmensidad que no podemos abarcar con la vista y menos con el conocimiento, sólo la imaginación se acerca a ese todo que pretendemos construir.

No podemos tener una imagen del Universo completo, es demasiado grande para que eso sea posible y sólo, pequeñas regiones del mismo podemos captar con nuestros telescopios que nos enseñan regiones más o menos lejanas del inmenso Cosmos. En cualquier parte que podamos mirar y observar, nos daremos cuenta de que las cosas que allí puedan pasar, son las mismas que pasan en otros lugares, toda vez que, el Universo se rige por leyes que actúan en todas partes de la misma manera. Muchos, desde hace mucho tiempo, pensaron en todas esas cuestiones.

Tales nació en la ciudad de Mileto en el año 639 a. de C. Fue el primero de los 7 sabios de Grecia y era matemático, geógrafo, pensador, astrónomo y astrólogo. Hijo de Examio e Cleóbula. Se marchó a Egipto para formarse con los sacerdotes del faraón en Geometría, astrología y física, allí aprendió cosas tan útiles como medir las pirámides por la longitud de la sombra. Era experto en astrosofía (algo que unía astronomía con filosofía) y que le daba el título de rudito en el más alto nivel. Se cuenta de él que, un día caminaba, de noche, observando las estrellas y cayó en un socabon que había en el suelo. Él fue el primero en dar al Agua la importancia que tiene para la vida.
Hoy trataré de dejar aquí una insignificante brizna de toda esa búsqueda, desesperada, por ese saber incansablemente perseguido por la especie humana que,deseosa de conocer todos aquellos misterios encerrados dentro de esa burbuja que llamamos Universo, no ha dejado, desde que Tales de Mileto desterró la mitología para emplear la lógica, de buscar el por qué del mundo, de los cielos y, en fin, de la Naturaleza. Claro que, desde aquel entonces hasta ahora, mucho es lo que nuestra curiosidad nos ha podido dar de ese saber que buscamos y del que no todos, hanestado siempre seguros de lograr.
Por ejemplo:
No olvidemos que, en el siglo XIX, algunos científicos declararon que la composición de las estrellas estaría siempre fuera del alcance del experimento, y, que la única manera que tendríamos de conocerlas sería la de mirar al cielo y verlas allí, inalcanzables como puntos de luz brillantes y lejanos en la oscuridad del vacío del cosmos.Sin embargo, podemos decir hoy, recien cumplida la primera década del siglo XXI, , que no solo podemos saber la composición de las estrellas, sino también como nacen, “viven” y mueren, las distancias que las separan de nosotros y un sin fin de datos más que el estudio y la investigación nos ha posibilitado descubrir.

Las estrellas del cielo, ¡tan lejanas! ¡tan misteriosas! que en las noches oscuras nos envían guiños de complicidad, como si trataran de decirnos alguna cosa, como si nos estuvieran llamando. Fue tanto el misterio que en nuestras mentes sembraron las estrellas que, no hemos parado ni un momento por saber, no sólo de qué estaban hechas, sino como surgen a la vida, como se desarrollan sus mecanismos, como mueren y en qué se convierten después. Sabemos que las estrellas son importantes en nuestras vidas hasta el punto de que, sin ellas, no podríamos estar aquí. Una de ellas, a la que llamamos Sol, nos envía su luz y su calor haciendo posible la vida en el planeta Tierra, otra antes que el Sol, hace seguramente muchos miles de millones de años, regó el espacio con su materia estelar y, pasado el tiempo, se condenso (ayudada por la Fuerza de Gravedad) en lo que hoy conocemos como el Sistema Solar.
Nada más cierto que lo que quiere simbolizar esa enorme imagen del Pensador. Es un fiel reflejo de lo que, a través de los tiempos, ha sido el SER Humano. Nunca hemos dejado ni dejaremos de pensar, en ello está nuestro futuro. A las pruebas de la Historia me remito.


Particularmente creo que el ser humano es capaz de realizar todo aquello en lo que piensa dentro de unos limites racionales.Podremos, en un futuro no muy lejano, alargar de manera considerable la media de vida.Podremos colonizar otros planetas (terraformarlos) y explotar recurso mineros en las lunas de nuestro sistema solar (las grandes compañias petroleras estarían encantadas en Titán), los turistas irán al planeta Marte o a las lunas Ganímedes o Europa.Los transportes de hoy serán reliquias del pasado y nos trasladaremos mediantes sistemas de transportes aéreos más limpios, rápidos y exentos de colisiones, sus modernos censores lo impedirán.Tendremos computadoras de cifrado cuántico que harán más seguras las comunicaciones y el intercambio de datos será realmente el de la velocidad de c, y así en todos los campos del saber humano.
En el nombre “Internet del Futuro” se asocian una serie de conceptos y tecnologías que abarcan desde la infraestructura de red, dispositivos e interfaces, software y aplicaciones que compondrán el que en unos años conformará el panorama de las Tecnologías de Información y Comunicaciones.
Entre estos temas, aparece la red de redes de gran velocidad y llegando a todas partes, mediante nuevos dispositivos, con nuevas formas de interaccionar con el mundo digital, acceso fácil e inteligente los diferentes tipos de contenidos con mención especial a 3D, y todo ello soportado por innovadores modelos de negocio adaptados a este nuevo panorama.
A los jóvenes no hay que convencerles de que Internet es imprescindible. El futuro para ellos es ya hoy. Una reciente encuesta pone de relieve la enorme vocación juvenil de tomar la red como bandera generacional. De hecho ellos, los jóvenes lo van a construir y modelar a su gusto y, probablemente, el Internet del futuro poco se parecerá al Internet que conocemos hoy. Alguien ha dicho: “Hoy, Internet está en su Prehistoria”. Lleva toda la razón
Estamos inmersos en un avance exponencial, imparable.

Se podría decir que, gracias a los Aceleradores de Partículas, podemos jugar con los átomos para mirar en su interior y saber, de qué está hecha la Materia que nos confroma a nosotros, a las estrellas y a los mundos de las galaxias del Universo.
Otro ejemplo de una idea “inverificable” la tenemos en la existencia del átomo.En el siglo XIX, la hipótesis atómica se reveló como el paso decisivo en la comprensión de las leyes de la química y la termodinámica.Sin embargo, muchos físicos se negaban a creer que los átomos existieran realmente, los aceptaban como un concepto o herramienta matemática para operar en su trabajo que, por accidente, daba la descripción correcta del mundo.Hoy somos todavía incapaces de tomar imágenes directas del átomo debido al principio de incertidumbre de Heisenberg, aunque ahora existen métodos indirectos.En 1.905, Einstein proporcionó la evidencia más convincente, aunque indirecta, de la existencia de átomos cuando demostró que el movimiento browniano (es decir, el movimiento aleatorio de partículas de polvo suspendidas en un líquido) puede ser explicado como colisiones aleatorias entre las partículas y los átomos del líquido.
Ejemplo en el que se observa la variación de los valores de la dimensión de masa y de la dimensión del contorno calculada por el método del compás en los siguientes DLA.
Otra posibilidad de crecimiento DLA es el vertical. Las partículas se lanzan desde lo alto y las partículas fijas se sitúan en el fondo del recipiente. Se puede observar en la siguiente figura como cuando una formación sobresale, las de sus lados dejan de crecer. Esto es debido a que las más grandes absorben los recursos de las más pequeñas e impiden su crecimiento, fenómeno que se da en la naturaleza cuando un árbol grande impide que crezcan los que están a su alrededor quitándoles los recursos de luz, agua…
Por analogía, podríamos esperar la confirmación experimental de la física de la décima dimensión utilizando métodos indirectos que aún ni se han inventado o descubierto.En lugar de fotografiar el objeto que deseamos, quizá nos conformaríamos, de momento, con fotografiar la “sombra” del mismo.

Bueno, con la imagen de la sombra podemos tener una idea, bastante acertada de la imagen original, el movimiento lo delata.
También la existencia de los neutrinos, propuestos por Wolfgang Pauli en 1.930, para dar cuenta de la energía perdida en ciertos experimentos sobre radiactividad que parecían violar la conservación de la materia y la energía, también digo, era inverificable (en aquel momento).Pauli comprendió que los neutrinos serían casi imposibles de observar experimentalmente, porque interaccionarían muy débilmente y, por consiguiente muy raramente con la materia.La materia, toda la materia, si profundizamos en ella a niveles microscópicos, podremos comprobar el hecho de que, en un 99% está constituida de espacios vacíos y, siendo así, los neutrinos pueden atravesarla sin rozar siquiera sus átomos, de hecho, pueden atravesar la Tierra como si ni siquiera existiera y, al mismo tiempo, también nosotros somos atravesados continuamente por billones de neutrinos emitidos por el sol, incluso por la noche.
Unos quieren pesar planetas y otros neutrinos pero, todos quieren saber sobre los misterios del Universo
Hablando de neutrinos recuerdo cuando el experimento Opera de los neutrinos pusiera en tela de juicio la teoría de Einstein, la medición de la luz proveniente de las galaxias confirmaron por primera vez a escala cósmica la teoría de la relatividad del genio físico.Sin embargo, no en una, sino en varias ocasiones han querido quitarle al bueno de Einstein el honor de haber marcado el límite de velocidad en nuestro Universo.

Pauli admitió: ”He cometido el pecado más grave, he predicho la existencia de una partícula que nunca puede ser observada”. Él predijo la existencia del neutrino para explicar “la masa perdida” en procesos de desintegración.
Pero incluso Pauli, con todos sus enormes conocimientos, se equivocaba, y el neutrino ha sido comprobado mediante distintos métodos que no dejan dudas de su existencia. Incluso producimos regularmente haces de neutrinos en colisionadores de átomos, realizamos experimentos con los neutrinosemitidos por reactores nucleares y, detectamos su presencia en enormes depósitos de agua pesada colocados en profundas minas abandonadas en las entrañas de la Tierra. Cuando una espectacular supernova de iluminó en el cielo del hemisferio sur en 1.987, los físicos registraron una ráfaga de neutrinos que atravesaron sus detectores situados, precisamente, en profundas minas.

El Enorme recipiente lleno de agua pesada (SNOLSB), delatará a los neutrinos que lo atraviesen
Dentro de una antigua mina de Sudbury (Ontario, Canadá) está ubicado el complejo de investigación astrofísica SNOLAB. Una de sus instalaciones es el Observatorio de Neutrinos (ONS, en la imagen). Los neutrinos son partículas subatómicas con una masa tan ínfima —se ha calculado que menos de una milmillonésima parte de la masa de un átomo de hidrógeno— que pueden atravesar la materia ordinaria sin apenas perturbarla. La materia está “compuesta” en su mayor parte de vacío aunque nuestros ojos y nuestro cerebro (en primera instancia) no lo interpreten así.
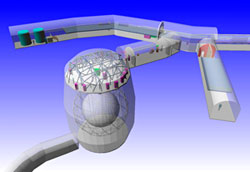
Para evitar la interferencia de otras partículas cósmicas este peculiar observatorio no está situado en la superfície, sino nada menos que a dos kilómetros de profundidad en el interior de la corteza terrestre. La instalación ONS es básicamente un “cazador de neutrinos” capaz de detectar estas partículas producidas por las reacciones de fusión en el interior Sol y así poder analizar la composición del núcleo de nuestra estrella. La cubierta acrílica del ONS contiene un kilotón (1.000 toneladas) de agua pesada (D2O) que al reaccionar con los neutrinos hacen que se produzcan unos azulados destellos de radiación o luz Cherenkov, llamada así en honor del destacado miembro de la Academia de Ciencias de la Unión Soviética Pável Alekséyevich Cherenkov (1904-1990), Premio Nobel de Física de 1958 por el descubrimiento e interpretación de este fenómeno. El primer detector orbital de partículas de estas características —Detector Cherenkov— fue uno de los equipos científicos instalados en el satélite Sputnik-3, lanzado por la URSS el mismo año en que Cherenkov recibiera el Nobel.

Si hablamos de la masa de Planck, lo hacemos de la masa de una partícula cuya longitud de onda Compton es igual a la Longitud de Planck, está dada por la ecuación de arriba, donde tenemos la constante de Planck racionalizada (la h cortada con ese palito arriba), c que es la velocidad de la luz y G la constante gravitacional, la descripción de una partícula elemental de esta masa.o partículas que interacionan con energías por partículas equivalentes a ellas a través de E = mc2, requiere una teoría cuántica de la Gravedad. Como la masa de Planck es del orden de 10-8 kg (equivalente a una energía de 1019 GeV) y, por ejemplo, la masa del protón es del ordende 10-27 Kg y las mayores energías alcanzables en nuestros aceleradores de partículas actuales son de un orden (aún pequeño) los efectos de gravitación cuántica no aparecen en los laboratorios de física de partículas. Sin embargo, en el universo primitivo se cree quen las partículas tenían ejnergías del orden de la energía de Planck (representada en la ecuación de abajo) que sería la energía necesaria para llegar hasta las cuerdas.
![[energia_de_Planck.png]](http://4.bp.blogspot.com/_js6wgtUcfdQ/SoRBCBYB-xI/AAAAAAAAG4Y/xVWzNgLGads/s1600/energia_de_Planck.png)
Echando una larga mirada a la historia de la ciencia, creo que existen motivos para un moderado optimismo. Witten está convencido de que la ciencia sería algún día capaz de sondear hasta las energías de Planck.
E. Witten, padre de la versión más avanzada de la teoría de supercuerdas, la teoría M, dice:
“No siempre es tan fácil decir cuáles son las preguntas fáciles y cuáles las difíciles.En el S.XIX, la pregunta de por qué el agua hierve a 100 grados era desesperadamente inaccesible.Si usted hubiera dicho a un físico del siglo XIX que hacia elS. XX sería capaz de calcularlo, le habría parecido un cuento de hadas…. La teoría cuántica de campos es tan difícil que nadie la creyó completamente durante veinticinco años.”
Lo mismo que otros muchos, no creo que tengamos que esperar un siglo antes de que nuestro ingenio y nuestras máquinas puedan sondear de manera indirecta la décima dimensión, alguien sabrá, durante ese periodo de tiempo, resolver esa teoría de campos de cuerdas o alguna otra formula no perturbativa.El problema es teórico, no experimental.Necesitamos alguien con el ingenio y la inteligencia necesaria (además de un enorme índice de observación), para saber “ver” lo que probablemente tenemos ante nuestras narices, utilizando para ello todos los datos e indicios existentes de gente como Einstein, Kaluza y Klein, Veneziano y Suzuki, el cuarteto de cuerdas de Princeton, Michio Kaku, Witten…, y tantos otros.
Suponiendo que algún físico brillante resuelva la teoría de campos de cuerdas y derive las propiedades conocidas de nuestro Universo, sigue existiendo el problema practico de cuándo seríamos capaces de aprovechar el poder de la teoría del hiperespacio.Existen dos posibilidades:
- Esperar que nuestra civilización alcance la capacidad para dominar energías millones de veces mayores que las de hoy.
- Encontrar civilizaciones extraterrestres que, más avanzadas, hayan dominado el arte de manipular el Hiperespacio.

Pero, si no son como esta…¡Mejor!
3. Antes de que Edison (robara las ideas de Tesla) y con sus otros colaboradores aprovecharan los descubrimientos de Faraday y las ecuaciones de Maxwell, sobre la electricidad y el magnetismo, para explotarlos de manera práctica, pasaron unos setenta años.
La civilización moderna depende crucialmente del aprovechamiento de esta fuerza.La fuerza nuclear fue descubierta casi con el cambio de siglo, pasó todo el siglo XX y estamos en la primera década del XXI, han pasado 100 años, y, sin embargo, todavía no tenemos medios de aprovecharla con éxito en reactores de fusión, la energía limpia que produce el Sol.
El próximo paso, el aprovechar la potencia de la teoría de campo unificado, requiere un salto mucho mayor en nuestra tecnología, aunque sea un salto que probablemente tendrá implicaciones muchísimo más importantes.
El problema reside en que obligamos a la teoría de supercuerdas a responder preguntas sobre energías cotidianas, cuando su “ámbito natural” está en la energía de Planck.Energía que sólo fue liberada en el propio instante de la creación.Es decir, la teoría de supercuerdas es una teoría de la propia creación, así nos puede explicar todas las partículas y la materia, las fuerzas fundamentales y el espacio-tiempo, es decir, es la teoría del propio Universo.
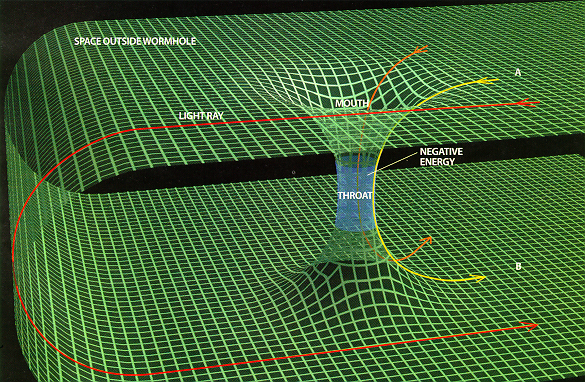
El dolor de cabezas que nos causa pensar en el espacio-tiempo y en el cómo podemos desplazarnos por él a grandes distancias de tiempo y también de espacio. ¿Se conseguirá alguna vez? ¿Será cierto que existen los Agujeros de Gusano? ¿Podremos alguna vez construir naves que surquen el Hiperespacio hacia otras galaxias y otros mundos?
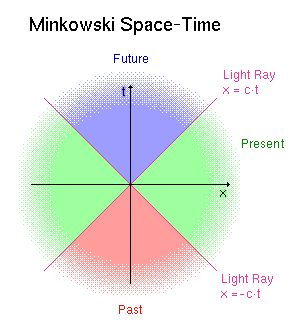
Durante estos comentarios, frecuentemente he reseñado la palabra “espacio-tiempo” refiriéndome a una geometría que incluye las tres dimensiones espaciales y una cuarta dimensión temporal.En la física newtoniana, el espacio y el tiempo se consideraban como entidades separadas y el que los sucesos fueran simultáneos o no era una materia que se consideraba como obvia para cualquier observador capacitado.
En el concepto de Einstein del universo físico, basado en el sistema de geometría inventada por H. Minkowski (1864-1909), el espacio y el tiempo estaban considerados como enlazados, de manera que dos observadores en movimiento relativo podían estar en desacuerdo sobre la simultaneidad de sucesos distantes.En la Geometría de Minkowski (inspirada a partir de la teoría de la relatividad especial de Einstein), un suceso se consideraba como un punto de universo en un continuo de cuatro dimensiones.
Pero volvamos a las supercuerdas.El problema fundamental al que se enfrenta esta teoría es este: de los millones de universos posibles que pueden ser generados matemáticamente por la teoría de supercuerdas, ¿cuál es el correcto? Como ha dicho David Gross:
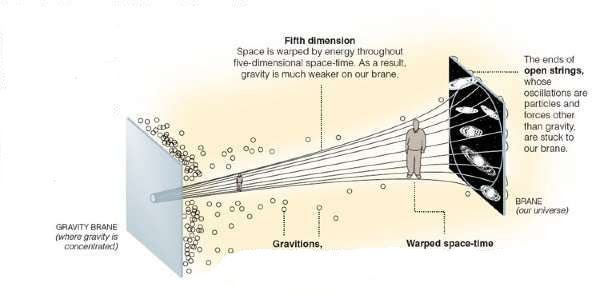
“Existen millones y millones de soluciones con tres dimensiones espaciales. Existe una enorme abundancia de soluciones clásicas posibles… Esta abundancia de riqueza era originalmente muy satisfactoria porque proporcionaba evidencia de que una teoría como la de la cuerda heterótica podía tener un aspecto muy parecido al mundo real. Estas soluciones, además de tener cuatro dimensiones espacio-temporales, tenían otras muchas propiedades que se asemejaban a nuestro mundo: el tipo correcto de partículas tales como quarks y Leptones, y el tiempo correcto de interacciones… Esto constituyó una fuente de excitación en su momento.”
Es difícil escenificar lo que las supercuerdas son, nunca nadie pudo ver ninguna
Gross, sin embargo, advierte que aunque alguna de estas soluciones están muy próximas al modelo estándar, otras dan lugar a propiedades físicas muy embarazosas e indeseables, lo que finalmente se traduce en una auténtica incomodidad o problema, ya que tenemos muchas soluciones pero ninguna forma aceptable de escoger entre ellas.Además algunas tienen propiedades deseadas y otras potencialmente desastrosas.
Un profano, al oir esto por primera vez, puede quedar intrigado para preguntar: ¿por qué no calcular simplemente que solución se adapta o prefiere la cuerda? Puesto que la teoría de cuerdas es una teoría bien definida, parece enigmático que los físicos no puedan calcular la respuesta.
Lo único seguro es que los físicos seguirán trabajando a la búsqueda de la solución que, más pronto o más tarde, llegará.
Efecto túnel a través del espacio y del tiempo
¡Extraña mecánica cuántica!
Estaría bien poder saber como un electrón, cuando absorbe un fotón, desaparece del lugar que ocupa y, de manera instántanea, aparece en otro lugar más ener´getico sin haber recorrido la distancia que separa ambos lugares, es el efecto túnel o salto cuántico. ¿Cuánto podríamos ganar si aprendiéramos como se hacer eso?
En definitiva, estamos planteando la misma cuestión propuesta por Kaluza, cuando en 1.919, escribió una carta a Einstein proponiéndole su teoría de la quinta dimensión para unificar el electromagnetismo de James Clark Maxwell y la propia teoría de la relatividad general. ¿Dónde está la quinta dimensión?, pero ahora en un nivel mucho más alto.Como Klein señaló en 1.926, la respuesta a esta cuestión tiene que ver con la teoría cuántica.Quizá el fenómeno más extraordinario (y complejo) de la teoría cuántica es el efecto túnel.
El efecto túnel se refiere al hecho de que los electrones son capaces de atravesar una barrera al parecer infranqueable hacia una región que estaría prohibida si los electrones fuesen tratados como partículas clásicas.El que haya una probabilidad finita de que un electrón haga un túnel entre una región clásicamente permitida a otra que no lo está, surge como consecuencia de la mecánica cuántica.El efecto es usado en el diodo túnel.La desintegración alfa es un ejemplo de proceso de efecto túnel.
Antes preguntábamos, en relación a la teoría de Kaluza – Klein, el destino o el lugar en el que se encontraba la quinta dimensión.
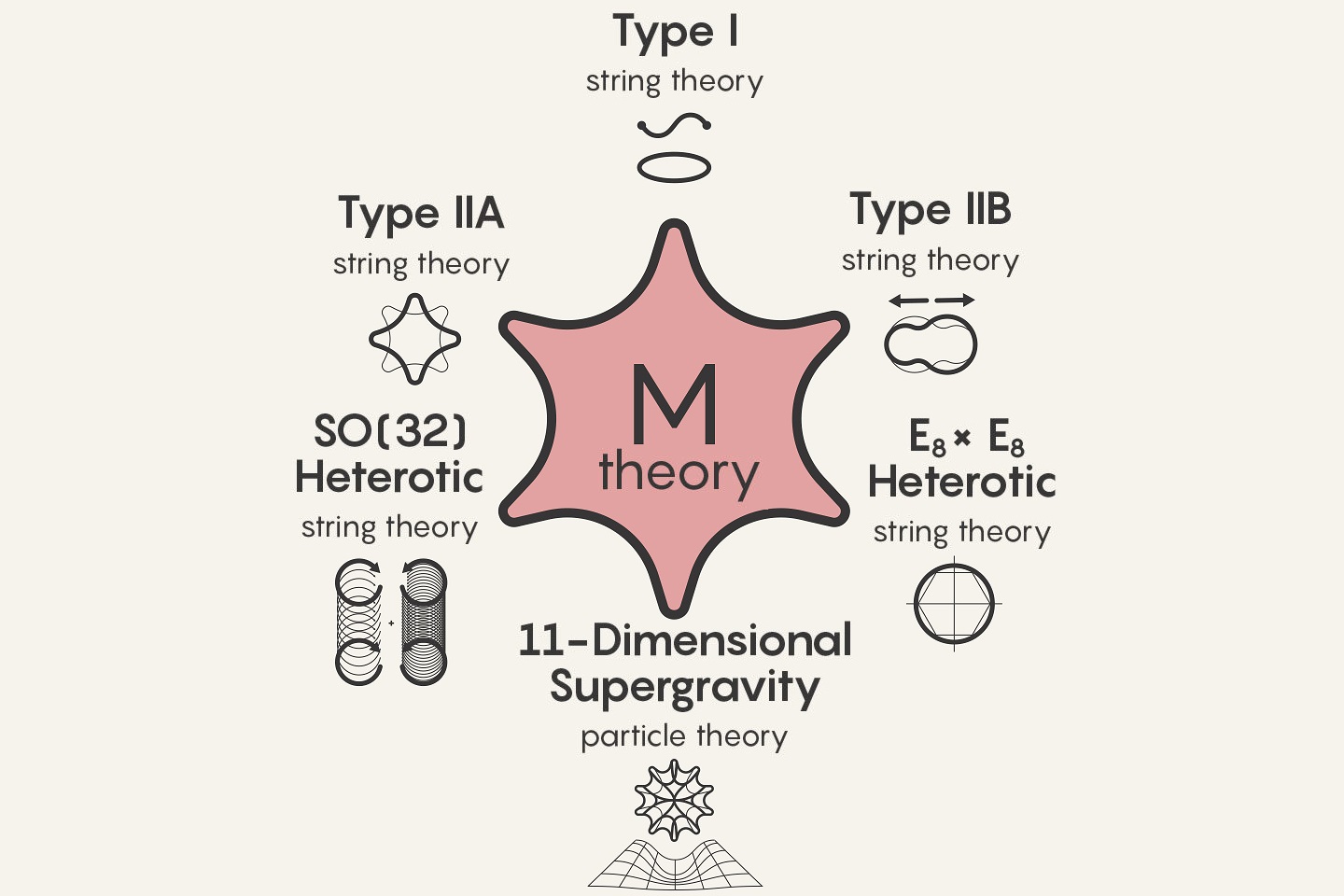
El profesor Teodor Kaluza nos hablaba de la Quinta Dimensión que unificaba la Relatividad de Einsteincon la Teoría de Maxwell. Todo en cinco dimensiones…Ahí comenzó toda la historia que después, desembocaron enm las supersimetrías, supergravedad, cuerdas y supercuerdas, cuerda heteráotica y teoría M…¿Qué vendrá después?
La respuesta de Klein a esta pregunta fue ingeniosa al decir que estaba enrollada o compactada en la distancia o límite de Planck, ya que, cuando comenzó el Big Bang, el Universo se expandió sólo en las cuatro dimensiones conocidas de espacio y una de tiempo, pero esta dimensión no fue afectada por la expansión y continua compactada en Lp=√(Għ/c3),cuyo valor es del orden de 10-35 metros, distancia que no podemos ni tenemos medios de alcanzar, es 20 ordenes de magnitud menor que el protón que está en 10 con exponente -15 metro.
Pues las dimensiones que nos faltan en la teoría decadimensional, como en la de Kaluza – Klein, también están compactada en una recta o en un círculo en esa distancia o límite de Planck que, al menos por el momento, no tenemos medios de comprobar dada su enorme pequeñez menor que un protón.
¿Cómo pueden estar enrolladas unas dimensiones?

Bueno, igual que para explicar de manera sencilla la gravedad mediante el ejemplo de una sábana estirada por los 4 extremos, en la que ponemos un enorme peso en su centro y se forma una especie de hondonada que distorsiona la superficie antes lisa de la sábana, al igual que un planeta distorsiona el espacio a su alrededor, de manera tal que cualquier objeto que se acerca a la masa del objeto pesado, se ve atraído hacia él.Pues bien, en las dimensiones de espacio enrolladas, utilizamos el símil de la sábana con bandas elásticas en las esquinas.
La sábana que tenemos es pequeña y la cama es grande.Con esfuerzo logramos encajar las cuatro esquinas, pero la tensión es demasiado grande; una de las bandas elásticas salta de una esquina, y la sábana se enrolla. Este proceso se llama ruptura de simetría.La sábana uniformemente estirada posee un alto grado de simetría.La sábana se enrolla.Se puede girar la cama 180º alrededor de cualquier eje y la sábana permanece igual.Este estado altamente simétrico se denomina falso vacío.Aunque el falso vacío aparece muy simétrico, no es estable. La sábana no quiere estar en esta condición estirada. Hay demasiada tensión y la energía es demasiado alta.Pero, la sábana elástica salta y se enrolla.La simetría se rompe, y la sábana pasa a un estado de energía más baja con menor simetría. Si notamos la sábana enrollada 180º alrededor de un eje ya no volvemos a tener la misma sábana.

Reemplacemos ahora la sábana por el espacio-tiempo decadimensional, es espacio-tiempo de simetría definitiva.En el comienzo del tiempo, el universo era perfectamente simétrico.Si alguien hubiera estado allí en ese instante, podría moverse libremente y sin problemas por cualquiera de las diez dimensiones. En esa época la Gravedad y las fuerzas débiles y fuertes y electromagnéticas estaban todas ellas unificadas por la supercuerda.Sin embargo, esta simetría no podía durar.El Universo decadimensional, aunque perfectamente simétrico, era inestable, la energía existente muy alta, exactamente igual que la sábana, estaba en un falso vacío. Por lo tanto, el paso por efecto túnel hacia un estado de menor energía era inevitable. Cuando finalmente ocurrió el efecto túnel, tuvo lugar una transición de fase y se perdió la simetría.

La imaginación no tiene límites y, la Naturaleza tampoco
Puesto que el Universo empezó a dividirse en un Universo de cuatro y otro de seis dimensiones, el universo ya no era simétrico. Seis dimensiones se habían enrollado (como la sábana elástica).Pero nótese que la sábana puede enrollarse de cuatro maneras, dependiendo de qué esquina haya saltado.Para el universo decadimensional, sin embargo, existen aparentemente millones de modos de enrollarse.Para calcular que estado prefiere el Universo decadimensional, necesitamos resolver la teoría de campos de cuerdas utilizando la teoría de transiciones de fase, el problema más difícil en la teoría cuántica.
Las transiciones de fase no son nada nuevo. Trasladémoslo a nuestras propias vidas.En un libro llamado PASAJES, el autor, Gail Sheehy destaca que la vida no es un flujo continuo de experiencias, como parece, sino que realmente pasa por varios estadios, caracterizados por conflictos específicos que debemos resolver y por objetivos que debemos cumplir.
El psicólogo Eric Ericsson llegó a proponer una teoría de estadios psicológicos del desarrollo.Un conflicto fundamental caracteriza cada fase.Si este conflicto no queda resuelto, puede enconarse e incluso provocar una regresión a un periodo anterior.Análogamente, el psicólogo Jean Piaget demostró que el desarrollo mental de la primera infancia tampoco es un desarrollo continuo de aprendizaje, sino que está realmente caracterizado por estadios discontinuos en la capacidad de conceptualización de un niño.Con un mes de edad, un niño puede dejar de buscar una pelota una vez que ha rodado fuera de su campo de visión.Sin comprender que la pelota existe aunque no la vea.Al mes siguiente, esto resultará obvio para el niño.
¡Siempre aprendiendo! Jugando comenzamos a conocer cómo es el mundo
Esta es la esencia de la dialéctica.Según esta filosofía, todos los objetos (personas, gases, estrellas, el propio Universo) pasan por una serie de estadios.Cada estadio está caracterizado por un conflicto entre dos fuerzas opuestas.La naturaleza de dicho conflicto determina, de hecho, la naturaleza del estadio.Cuando el conflicto se resuelve, el objeto pasa a un objetivo o estadio superior, llamado síntesis, donde empieza una nueva contradicción, y el proceso pasa de nuevo a un nivel superior.
Los filósofos llaman a esto transición de la “cantidad” a la “cualidad”.Pequeños cambios cuantitativos se acumulan hasta que, eventualmente, se produce una ruptura cualitativa con el pasado.Esta teoría se aplica también a las sociedades o culturas.Las tensiones en una sociedad pueden crecer espectacularmente, como la hicieron en Francia a finales del siglo XVIII.Los campesinos se enfrenaban al hambre, se produjeron motines espontáneos y la aristocracia se retiró a sus fortalezas.Cuando las tensiones alcanzaron su punto de ruptura, ocurrió una transición de fase de lo cuantitativo a los cualitativo: los campesinos tomaron las armas, tomaron Paris y asaltaron la Bastilla.
Parece que el “vacio” está bastante lleno de cosas…que no llegamos a comprender
Las transiciones de fases pueden ser también asuntos bastante explosivos.Por ejemplo, pensemos en un río que ha sido represado.Tras la presa se forma rápidamente un embalse con agua a enorme presión Puesto que es inestable, el embalse está en el falso vacío.El agua preferiría estar en su verdadero vacío, significando esto que preferiría reventar la presa y correr aguas abajo, hacia un estado de menor energía.Así pues, una transición de fase implicaría un estallido de la presa, que tendría consecuencias desastrosas.
También podría poner aquí el ejemplo más explosivo de una bomba atómica, donde el falso vacío corresponde al núcleo inestable de uranio donde residen atrapadas enormes energías explosivas que son un millón de veces más poderosas, para masas iguales, que para un explosivo químico.De vez en cuando, el núcleo pasa por efecto túnel a un estado más bajo, lo que significa que el núcleo se rompe espontáneamente.Esto se denomina desintegración radiactiva.Sin embargo, disparando neutrones contra los núcleos de uranio, es posible liberar de golpe esta energía encerrada según la formula de EinsteinE=mc2, por supuesto, dicha liberación, es una explosión atómica ¡menuda transición de fase!
Una transición de fase que perseguimos, es dominar la Galaxia, poder moldearla con nuestras manos, y, si eso llega a ser posible alguna vez, seremos los señores del Hiperespacio.Para entonces, los misteriosos agujeros negros no tendrán secretos para nosotros, las energías perdidas tampoco y…los viajes en el tiempo, serán cosa cotidiana. ¿Será realidad algún día ese pensamiento?
Las nuevas características descubiertas por los científicos en las transiciones de fases es que normalmente van acompañadas de una ruptura de simetría.Al premio Nobel Abdus Salam le gusta la ilustración siguiente: consideremos una mesa de banquete circular, donde todos los comensales están sentados con una copa de champán a cada lado.Aquí existe simetría.Mirando la mesa del banquete reflejada en un espejo, vemos lo mismo: cada comensal sentado en torno a la mesa, con copas de champán a cada lado.Asimismo, podemos girar la mesa de banquete circular y la disposición sigue siendo la misma.
Rompamos ahora la simetría. Supongamos ahora que el primer comensal toma la copa que hay a su derecha.Siguiendo la pauta, todos los demás comensales tomaran la copa de champán de su derecha. Nótese que la imagen de la mesa del banquete vista en el espejo produce la situación opuesta. Cada comensal ha tomado la copa izquierda. De este modo, la simetría izquierda-derecha se ha roto.
Así pues, el estado de máxima simetría es con frecuencia también un estado inestable, y por lo tanto corresponde a un falso vacío.
Con respecto a la teoría de supercuerdas, los físicos suponen (aunque todavía no lo puedan demostrar) que el universo decadimensional original era inestable y pasó por efecto túnel a un universo de cuatro y otro de seis dimensiones.Así pues, el universo original estaba en un estado de falso vacío, el estado de máxima simetría, mientras que hoy estamos en el estado roto del verdadero vacío.
El universo era opaco, y se hizo transparente cuando se liberaron los fotones
Al principio, cuando el Universo era simétrico, solo existía una sola fuerza que unificaba a todas las que ahora conocemos, la gravedad, las fuerzas electromagnéticas y las nucleares débil y fuerte, todas emergían de aquel plasma opaco de alta energía que lo inundaba todo.Más tarde, cuando el Universo comenzó a enfriarse, se hizo transparente y apareció la luz, las fuerzas se separaron en las cuatro conocidas, emergieron las primeras quarks para unirse y formar protones y neutrones, los primeros núcleos aparecieron para atraer a los electrones que formaron aquellos primeros átomos.Doscientos millones de años más tarde, se formaron las primeras estrellas y Galaxias. Con el paso del tiempo, las estrellas sintetizaron los elementos pesados de nuestros cuerpos, fabricados en supernovas que estallaron, incluso antes de que se formase el Sol.Podemos decir, sin temor a equivocarnos, que una supernova anónima explotó hace miles de millones de años y sembró la nube de gas que dio lugar a nuestro sistema solar, poniendo allí los materiales complejos y necesarios para que algunos miles de millones de años más tarde, tras la evolución, apareciéramos nosotros.

Las estrellas evolucionan desde que en su núcleo se comienza a fusionar Hidrógeno en Helio, de los elementos más ligeros a los más pesados.Avanza creando en el Horno termonuclear, cada vez, metales y elementos más pesados.Cuando llega al hierro y explosiona en la forma explosiva deuna super nova.Luego, cuando este material estelar es otra vez recogido en una nueva estrella rica en hidrógeno, al ser de segunda generación (como nuestro Sol), comienzo de nuevo el proceso de fusión llevando consigo materiales complejos de aquella supernova.
Puesto que el peso promedio de los protones en los productos de fisión, como el cesio y el kripton, es menor que el peso promedio de los protones de uranio, el exceso de masa se ha transformado en energía mediante E=mc2.Esta es la fuente de energía que subyace en la bomba atómica.

Restos de Hipernova que produce cambios hacia el futuro del Universo
Así pues, la curva de energía de enlace no solo explica el nacimiento y muerte de las estrellas y la creación de elementos complejos que también hicieron posible que nosotros estemos ahora aquí y, muy posiblemente, será también el factor determinante para que, lejos de aquí, en otros sistemas solares a muchos años – luz de distancia, puedan florecer otras especies inteligentes que, al igual que la especie humana, se pregunten por su origen y estudien los fenómenos de las fuerzas fundamentales del Universo, los componentes de la materia y, como nosotros, se interesen por el destino que nos espera en el futuro.
Cuando alguien oye por vez primera la historia de la vida de las estrellas, generalmente (lo sé por experiencia), no dice nada, pero su rostro refleja escepticismo. ¿Cómo puede vivir una estrella 10.000 millones de años? Después de todo, nadie ha vivido tanto tiempo como para ser testigo de su evolución.
Sin embargo, tenemos los medios técnicos y científicos para saber la edad que tiene, por ejemplo, el Sol.



El Sol que nos da la vida con su luz y su calor
El Sol es la estrella central de nuestro sistema, motor indispensable que hace posible la vida en la Tierra a través de su luz y el calor. Regula el clima, posibilita la fotosíntesis en plantas, genera energía renovable y es fundamental para la salud humana al activar la síntesis de vitamina D.
Nuestro Sol, la estrella alrededor de la que giran todos los planetas de nuestro Sistema Solar (hay que eliminar a Plutón de la lista, ya que, en el último Congreso Internacional, han decidido, después de más de 20 años, que no tiene categoría para ser un planeta), la estrella más cercana a la Tierra (150 millones de km=UA), con un diámetro de 1.392.530 km, tiene una edad de 4.500 millones de años.
Es tal su densidad, es tal su enormidad que, como se explicó en otro ensayo anterior de este mismo trabajo, cada segundo, transforma por medio de fusión nuclear, 4.654.000 Toneladas de Hidrógeno en 4.650.000 Toneladas de Helio, las 4.000 toneladas restantes, son lanzadas al espacio exterior en forma de luz y calor de la que, una parte nos llega a la Tierra y hace posible la vida. Se calcula que al Sol le queda material de fusión para otros 4.500 millones de años.Cuando transcurra dicho periodo de tiempo, se convertirá en una gigante roja, eyectará sus materiales exteriores al espacioy se transformará finalmente en una estrella enana blanca.Para entonces, ya no podremos estar aquí.
Cuándo mentalmente me sumerjo en las profundidades inmensas del Universo que nos acoge, al ser consciente de su enormidad, veo con claridad meridiana lo insignificante que somos, en realidad, en relación al universo, como una colonia de bacterias que habitan en una manzana, allí tienen su mundo, lo más importante para ellas, y no se paran a pensar que puede llegar un niño que, de un simple puntapié, las envíe al infierno.
Sólo somos importantes a nivel local, pretendemos serlo a otros niveles pero, ¿será posible eso? De lo que no cabe duda alguna es que, es el núcleo familiar nuestra más importante huella en el Universo, lo demás, viene por añadidura
Igualmente, nosotros nos creemos importantes dentro de nuestro cerrado y limitado mundo en el que, de momento, estamos confinados.Podemos decir que hemos dado los primeros pasos para dar el salto hacia otros mundos, pero aún nos queda un largo recorrido por delante.

Tendremos que dominar la energía del Sol, ser capaces de fabricar naves espaciales que sean impenetrables a las partículas que a cientos de miles de trillones circulan por el espacio a la velocidad de la luz, poder inventar una manera de imitar la gravedad terrestre dentro de las naves para poder hacer la vida diaria y cotidiana dentro de la nave sin estar flotando todo el tiempo, y, desde luego, buscar un combustible que procure velocidades relativistas, cercanas a c, ya que, de otra manera, el traslado por los mundos cercanos se haría interminable.Finalmente, y para escapar del sistema solar, habría que buscar la manera de romper la barrera de la velocidad de la luz.

¿Viajar en el tiempo? Bueno, nosotros miramos para otro lado tratando de soslayar esa verdad que nos dice que no podemos viajar por el Espacio y visitar otyros mundos, otras estrellas. Sin embargo, nos desentendemos de estas carencias (físicas-biológicas) y tecnológicas, y vamos más allá, ¡Queremos viajar en el Tiempo!

No tenemos remedio
Nuestra imaginación sólo es comparable a la inmensidad del Universo. Ahí radica nuestra verdadera riqueza. La curiosidad del SER humano le empuja de manera irremediable hacia su destino en las estrellas.
Emilio silvera v.
Mar
10
Conocer la Naturaleza, sus secretos
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Los secretos del Universo ~
Clasificado en Los secretos del Universo ~
 Comments (1)
Comments (1)

El amanecer del día es tan antiguo que se pierde en la noche de los tiempos
Desde tiempos inmemoriales, se hizo cada vez más evidente para nuestros antepsados que en la Naturaleza se daban sucesos predecibles y también impredecibles. Unos eran repetitivos, como el día y la noche y otros, nunca se veían venir, como los temblores de la Tierra.


Así, los aspectos impredecibles eran peligrosos y temibles. En aquellos tiempos remotos, decían que eran castigos de los dioses por el compiortamiento humano y, ahí estaban incluídos desde la erupción de un volcán, un Tsunami o un terremoto. También plagas, desastres y pestilencias que asotaron al mundo se vieron como un castigo.

Mucho menos interés tenían las predecibilidades de los comportamientos de la Naturaleza que, por cotidianos, se veían naturales y eran, al ser conocidos, aprovechados de una u otra manera. Advirtiendo y explotando los cambios periódicos del entorno, podían prepararse las cosechas, hacer acopios para el invierno y construir defensas contra las incursiones del viento y de las aguas. Estas regularidades de la Naturaleza se reflejaron en el comportamiento de las Sociedades estables que se estructuraron alrededor de estosm sucesos y generaron una creencia en la ley y el orden a escala cósmica.
Lo impredecible
Finalmente, ayudadas por la fe monoteísta de muchas sociedades occidentales, estas creencias alimentaron la idea de que existían cosas llamadas “leyes de la Naturaleza” que son válidas en todos los tiempos y lugares. Estas leyes universales prescriben el modo en que se comportaran las cosqas y no, como las leyes humanas que son cambiantes y dependen de criterios que no siempre están aconsejados por la razón.
Hemos llegado a comprender que las leyes de cambio siempre pueden reemplazarse por el requisito de que algún otro aspecto de la Naturaleza no cambie: es lo que llaman el principio de conservación o una invariancia de la Naturaleza. Se cree que la energía es un ejemplo primordial. Puede ser intercambiada y reorganizada de formas diferentes pero, al final, cuando se hace la suma, la energía total debe ser siempre la misma.
Hasta la década de 1970 los físicos estaban impresionados por esta correspondencia entre leyes de la Naturaleza y pautas invariables que empezaron a explotar el catálogo de pautas invariables en busca de candidatos para las leyes de cambio asociadas. Las cuatro fuerzas básicas de la Naturaleza -Gravedad, electricidad y magnetismo, radiactividad e interacciones nucleares- eran descritas por teorías de este tipo. Cada una de estas cuatro fuerzas de la Naturaleza corresponde a una pauta independiente que se conserva cuando algo sucede en la Naturaleza: cuando un núcleo radiactivo se desintegra o un imán en movimiento en la dinámo de una bicicleta produce una corriente eléctrica.
Todo esto eran buenas noticias para los físicos. A mediados de la década de 1970 tenían teorías separadas para la Gravedad, el Electromagnetismo, la Fuerza débil (de la que se deriva la radiactividad) y la Fuerza fuerte (de la que se deriva las fuerzas nucleares) que estaban de acuerdo con los sucesos observados. La conservación de una pauta invariable en cada caso requería que existiese la respectiva fuerza de la Naturaleza y determinara en detalle cómo y sobre qué debería actuar. ¿Por qué debería el mundo estar gobernado por cuatro pautas invariables diferentes?

Hemos aprendido que las fuerzas de la naturaleza no son tan diferentes como a primera vista nos pueden parecer. Parecen tener intensidades muy diferentes y actuar sobre partículas elementales diferentes. Pero esto es una ilusión creada por nuestra necesidad de habitar un lugar en el Universo donde la temperatura es más bien baja; suficientemente baja para que existan átomos y moléculas. Conforme la temperatura aumenta y las partículas elementales de materia colisionan entre sí a energías cada vez más altas, las fuerzas separadas que gobiernan nuestro mundo quiescente a baja temperatura se hacen cada vez más parecidas. Las fuerzas fuertes se debilitan y las fuerzas débiles se fortalecen. aparecen nuevas partículas a medida que se alcanzan temperaturas más elevadas y consiguen producir interacciones entre las familias separadas de partículas que, a bajas temperaturas, parecen estar aisladas entre sí.

Gran número de partículas generadas después del choque en el Gran Colisionador de Hadrones
Las partículas viajan a velocidades cercanas a la velocidad de la luz y haces de hadrones chocan con tal violencia que, a muchos miles de millones de grados de temperatura, surge una nueva materia y partículas desconocidas que, durante una pequeñísima fracción de tiempo – de una trillonésima de segundo- son captadas por las potentes computadoras para que, posteriormente, los expertos experimentadores, diluciden los misterios que han surgido de ese big bang en miniatura.
Así, poco a poco, a medida que alcanzamos esas inimaginables condiciones de la temperatura “última” que Max Planck encontró definida por las cuatro constantes G, k, c y h, esperamos que las diferencias se vayan borrando completamente y que las fuerzas de la Naturaleza presenten al fín, un único frente unido como se cree que sucedía al principio de todo, antes de que las temperaturas iniciales del Universo se enfriaran y diera lugar a que, la única fuerza existente en aquel momento, se escindiera en las cuatro que hoy conocemos.
Ahí, en ese recinto misterioso se producen conexiones sin fin que generan los pensamientos
Todo esto que aquí podemos contar es posible gracias a que existe algo que llamamos cerebro en el que se estructura un algo que llamamos mente y que, ha llegado a un nivel de consciencia de inusitada grandeza, capaz de percibir esos parámetros y pautas de la Naturaleza que la hacen como es y que, permiten que dicha mente pueda estar presente para observar todo lo que aquí ocurre en tan inmenso Universo.
Hay cosas que se nos escapan pero que, de alguna manera presentimos. Por ejemplo, en nuestras vidas cotidianas, los efectos de la energía de vacío son ínfimos, diminutos, pero aún así detectables en pequeñas correcciones a los niveles de las energías de los átomos. En Teorías de campos relativistas, la energía de vacío está dada por una expresión matemáticamente idéntica y físicamente indistinguible de la famosa constante cosmológica, o por el contrario varia con el tiempo, algo que tendría consecuencias importantísimas para el destino del universo y que es un tema de investigación candente en cosmología, con varios experimentos propuestos para detectarlo.
Imaginar lo que puediera ser… siempre se nos ha dado muy bien y, a veces, hasta hemos acertado.
Es cierto que existen campos en los que tenemos dudas y queremos seguir avanzando, es mucha la ignorancia que sobre nuestros hombros cargamos pero, por ejemplo, si bien existe confusión e intriga acerca de su uso y factibilidad, la computación cuántica no es un sueño. De hecho, muchos expertos la ven como inevitable. En los computadores tradicionales, el procesamiento paralelo divide una tarea en partes y las delega a procesadores separados. La computación cuántica hace mas o menos lo mismo, solo que el procesamiento ocurre a nivel subatómico, donde rigen las leyes de la mecánica cuántica.
Mientras que un bit magnético tradicional puede representar solo un 1 o un 0, los bits cuánticos, o “qubits”, consistentes de atomos y partículas subatómicas ofrecen una gama de posibilidades exóticas. Un computador cuántico puede guardar datos en el espín de los electrónes, o en la posición de un cierto electrón. Un qubit, por ejemplo, puede ser 0, 1 y 0 y 1 al mismo tiempo, permitiendo la construcción de procesadores inmensamente más rápidos que los procesadores tradicionales.

Sabemos que, en el centro del átomo se encuentra un pequeño grano compacto aproximadamente 100.000 veces más pequeño que el propio átomo: el núcleo atómico. Su masa, e incluso más aún su carga eléctrica, determinan las propiedades del átomo del cual forma parte. Debido a la solidez del núcleo parece que los átomos, que dan forma a nuestro mundo cotidiano, son intercambiables entre sí, e incluso cuando interaccionan entre ellos para formar sustancias químicas (los elementos). Pero el núcleo, a pesar de ser tan sólido, puede partirse. Si dos átomos chocan uno contra el otro con gran velocidad podría suceder que los núcleos llegaran a chocar entre sí y entonces, o bien se rompen en trozos, o se funden liberando en el proceso partículas subnucleares. La nueva física de la primera mitad del siglo XX estuvo dominada por los nuevos acertijos que estas partículas planteaban.
Pero tenemos la mecánica cuántica; ¿es que no es aplicable siempre?, ¿cuál es la dificultad? Desde luego, la mecánica cuántica es válida para las partículas subatómicas, pero hay más que eso. Las fuerzas con que estas partículas interaccionan y que mantienen el núcleo atómico unido son tan fuertes que las velocidades a las que tienen que moverse dentro y fuera del núcleo están cerca de la velocidad de la luz, c, que es de 299.792’458 Km/s. Cuando tratamos con velocidades tan altas se necesita una segunda modificación a las leyes de la física del siglo XIX; tenemos que contar con la teoría de la relatividad especial de Einstein.

Esta teoría también fue el resultado de una publicación de Einstein de 1905. en esta teoría quedaron sentadas las bases de que el movimiento y el reposo son conceptos relativos, no son absolutos, como tampoco habrá un sistema de referencia absoluto con respecto al cual uno pueda medir la velocidad de la luz.
Pero había más cosas que tenían que ser relativas. En este teoría, la masa y la energía también dependen de la velocidad, como lo hacen la intensidad del campo eléctrico y del magnético.Einstein descubrió que la masa de una partícula es siempre proporcional a la energía que contienen, supuesto que se haya tenido en cuenta una gran cantidad de energía en reposo de una partícula cualquiera, como se denota a continuación:

Como la velocidad de la luz es muy grande, esta ecuación sugiere que cada partícula debe almacenar una cantidad enorme de energía, y en parte esta predicción fue la que hizo que la teoría de la relatividad tuviese tanta importancia para la física (¡y para todo el mundo!). Para que la teoría de la relatividad también sea autoconsistente tiene que ser holista, esto es, que todas las cosas y todo el mundo obedezcan a las leyes de la relatividad. No son sólo los relojes los que se atrasan a grandes velocidades, sino que todos los procesos animados se comportan de la forma tan inusual que describe esta teoría cuando nos acercamos a la velocidad de la luz. El corazón humano es simplemente un reloj biológico y latirá a una velocidad menor cuando viaje en un vehículo espacial a velocidades cercanas a la de la luz. Este extraño fenómeno conduce a lo que se conoce como la “paradoja de los gemelos”, sugerida por Einstein, en la que dos gemelos idénticos tienen diferente edad cuando se reencuentran después de que uno haya permanecido en la Tierra mientras que el otro ha viajado a velocidades relativistas.
Einstein comprendió rápidamente que las leyes de la gravedad también tendrían que ser modificadas para que cumplieran el principio relativista. Y, tras profundos pensamientos y continuados sufrimientos, él pudo elaborar su ecuación que es el reflejo de una de las mayores muestras de ingenio que han podido ser hechas por un humnano. Su Ecuación de campo de la Relatividad General.
![]()
De la ecuación de campo de Einstein (entre otras muchas cosas) nos sale el esquema de la curvatura del espacio-tiempo que se produce en presencia de grandes masas. Ahí, también está encerrado el exótico agujerom negro. En esa breve ecuación subyace la inmensidad del Cosmos, de su geometría y configuración. Así que, en el presente comentario, vamos a explicar una serie de cosas que ocurren y están aquí con nosotros en el Universo, e incluso, formar parte de nosotros mismos o hacen posible que podamos estar aquí.
Leyendo el material enviado por un amigo al que pidió ayuda, Einstein quedó paralizado. Ante él, en la primera página de una conferencia dada ante el Sindicato de Carpinteros, 60 años antes por un tal Riemann, tenía la solución a sus desvelos: el tensor métrico de Riemann, que le permitiría utilizar una geometría espacial de los espacios curvos que explicaba su relatividad general.

¡La belleza y los misterios del Universo!
Para poder aplicar el principio de la relatividad a la fuerza gravitatoria, el principio tuvo que ser extendido de la siguiente manera: no sólo debe ser imposible determinar la velocidad absoluta del laboratorio, sino que también es imposible distinguir los cambios de velocidad de los efectos de una fuerza gravitatoria.
Einstein comprendió que la consecuencia de esto era que la gravedad hace al espacio-tiempo lo que la humedad a una hoja de papel: deformar la superficie con desigualdades que no se pueden eliminar. Hoy en día se conocen muy bien las matemáticas de los espacios curvos, pero en el época de Einstein el uso de estas nociones matemáticas tan abstractas para formular leyes físicas era algo completamente nuevo, y le llevó varios años encontrar la herramienta matemática adecuada para formular su teoría general de la relatividad que describe cómo se curva el espacio en presencia de grandes masas como planetas y estrellas.
Claro que, no siempre es todo como creemos verlo, ni siempre estamos en disposición de elegir. Nada es lo que nos dicen nuestros sentidos que es. Y, lo que entendemos por libre albedrío, de la misma manera, está distorsionado por mil parámetros ajenos a nosotros que, sólo podemos ejercer de manera parcial y hasta el punto en que, el entorno nos lo permite.
¡Qué bonito es saber! A mi, me gustaría.
Emilio Silvera V.
Mar
10
Lo material solo se transforma, ¿Qué pasa con la Mente?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (1)
Comments (1)
Puede que cinetíficamente, las cosas sean como nos cuenta el maestro, se quema alguna cosa, se rteansforma en cenizas, que pesan menos que el “cuerpo” ortiginal, el resto se ha convertido en humo y otros materiales que se difuminan por la Atmósfera. Sin embargo, cuando lo que se quema es nuestro cuepo, nuestras Mentes nos dicen que, aunque el material que nos conformaba persiste de otra manera, algo nos lleva a pensar que, entre esas ceniza, ese humo y esos otros elementos que se están confundiendo con el aire atmosférico, no está presente ese algo que llamamos Mente, espíritu, alma, Ente esencial del Ser. ¿Ha donde ha ido?
- Cese de la Conciencia: Cuando el cerebro muere debido a la falta de oxígeno y energía (lo que ocurre poco después de que el corazón deja de latir), la conciencia se desvanece por completo.
- Destrucción Física: Al cremarse, el cerebro —asiento de la memoria y la personalidad— se vaporiza; al enterrarse, se descompone. En ambos casos, la estructura física necesaria para generar el “yo” deja de existir.
- Evidencia de Muerte Clínica: Estudios recientes indican que, aunque puede haber un breve aumento de actividad cerebral segundos antes o después de la muerte clínica (una especie de “fogonazo” de memoria), esto es parte del proceso de apagado del cerebro, no una prueba de vida post-mortem.
- El “Yo” como subproducto: Para la ciencia convencional, el “yo” no existe independientemente del cerebro. Al desaparecer el soporte físico, la conciencia simplemente se detiene.


- Separación del Alma: La muerte no es el final, sino una transición. El espíritu se separa del cuerpo físico, el cual se considera un “envase” o vehículo temporal.
- La Cremación como Liberación: Muchas tradiciones ven la cremación no como una destrucción del ser, sino como un proceso acelerado de liberación del alma, permitiéndole desprenderse más rápidamente de la materia.
- Trascendencia y Reencarnación:
- Tradiciones Abrahámicas (Cristianismo, Islam, Judaísmo): El alma se dirige a un estado de juicio, para luego ir a un lugar de descanso (cielo o paraíso) o separación (infierno).
- Tradiciones Orientales (Hinduismo, Budismo): La conciencia trasciende y se reencarna en un nuevo cuerpo físico (reencarnación), ciclo que continúa hasta alcanzar la liberación final o Moksha.
- Conciencia como Energía: Desde una visión New Age o metafísica, la conciencia es energía no localizada que no muere, sino que se transforma y regresa a un estado de unidad con el universo.

- Experiencias Cercanas a la Muerte (ECM): Estudios sobre personas que han sobrevivido a la muerte clínica reportan experiencias de conciencia lúcida, sugiriendo a algunos investigadores que la conciencia podría no ser puramente producida por el cerebro, sino “recibida” o facilitada por él.
- Conservación de la Conciencia: Algunas teorías, como el Biocentrismo, sugieren que la vida y la conciencia son la base del universo, y que la muerte es solo un cambio en la forma de percibir esta conciencia.
Emilio Silvera V.
Mar
9
Las estrellas nos trajeron aquí
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Astrofísica ~
Clasificado en Astrofísica ~
 Comments (1)
Comments (1)

Las estrellas brillan en el cielo para hacer posible que nosotros estemos aquí descubriendo los enigmas del Universo y… de la vida inteligente. Venimos y tenemos nuestro origen en las entrañas de las estrellas, allí, en sus “hornos” nucleares, se fabricaron los materiales de los que estamos hechos todos los seres vivos. Y, sin temor a equivocarnos podríamos decir que somos “materia inerte” evolucionada hasta el nivel de la conciencia.
Pero está claro que todo el proceso estelar evolutivo inorgánico nos condujo desde el simple gas y polvo cósmico a la formación de estrellas y nebulosas solares hasta los planetas, la Tierra en particular, en cuyo medio ígneo describimos la formación de las estructuras de los silicatos, desplegándose con ello una enorme diversidad de composiciones, formas y colores, asistiéndose, por primera vez en la historia de la materia, a unas manifestaciones que contrastan con las que hemos mencionado en relación al proceso de las estrellas.
Desde el punto de vista del orden es la primera vez que nos encontramos con objetos de tamaño comparables al nuestro, en los que la ordenación de sus constituyentes es el rasgo más característico.
Al mismo tiempo nos ha parecido reconocer que esos objetos, es decir, sus redes cristalinas “reales”, almacenan información (memoria) que se nos muestra muy diversa y que puede cobrar interés en ciertos casos, como el de los microcristales de arcilla, en los que, según Cairns-Smith, puede incluso llegar a transmitirse.

No es fácil decir que, esa Nebulosa, está conformada por materia inerte, toda vez que, lo que ahí está presente, interacciona y evoluciona conforme a una serie de parámetros que, como las temperaturas y otros la transforman en objetos distintos de lo que ahora son simples gases y riadas de polvo.

Porque, ¿qué sabemos en realidad de lo que llamamos materia inerte? Lo único que sabemos de ella son los datos referidos a sus condiciones físicas de dureza, composición, etc; en otros aspectos ni sabemos si pueden existir otras propiedades distintas a las meramente físicas.
¿No os hace pensar que nosotros estemos hechos, precisamente, de lo que llamamos materia inerte?

Pero el mundo inorgánico es sólo una parte del inmenso mundo molecular. El resto lo constituye el mundo orgánico, que es el de las moléculas que contienen carbono y otros átomos y del que quedan excluidos, por convenio y características especiales, los carbonatos, bicarbonatos y carburos metálicos, los cuales se incluyen en el mundo inorgánico.


Según decía en páginas anteriores, los quarks u y d se hallan en el seno de los nucleones (protones y neutrones) y, por tanto, en los núcleos atómicos. Hoy día, éstos se consideran como una subclase de los hadrones.
La composición de los núcleos (lo que en química se llama análisis cualitativo) es extraordinariamente sencilla, ya que como es sabido, constan de neutrones y protones que se pueden considerar como unidades que dentro del núcleo mantienen su identidad. Tal simplicidad cualitativa recuerda, por ejemplo, el caso de las series orgánicas, siendo la de los hidrocarburos saturados la más conocida. Recordad que su fórmula general es CnH2n+2, lo que significa que una molécula de hidrocarburo contiene n átomos de carbono (símbolo C) y (2n+2) átomos de hidrógeno (símbolo H).
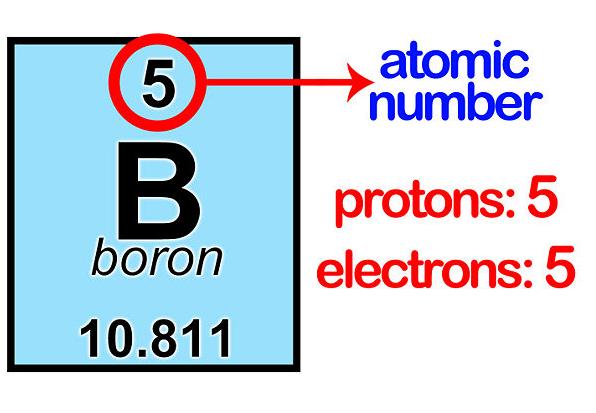

El número de protones y neutrones determina al elemento, desde el hidrógeno (el más simple), al uranio (el más complejo), siempre referido a elementos naturales que son 92; el resto son artificiales, los conocidos transuránicos en cuyo grupo están el einstenio o el plutonio, artificiales todos ellos.
Los núcleos, como sistemas dinámicos de nucleones, pertenecen obviamente a la microfísica y, por consiguiente, para su descripción es necesario acudir a la mecánica cuántica. La materia, en general, aunque presumimos de conocerla, en realidad, nos queda mucho por aprender de ella.
Hablemos un poco de moléculas.
El número de especímenes atómicos es finito, existiendo ciertas razones para suponer que hacia el número atómico 173 los correspondientes núcleos serían inestables, no por razones intrínsecas de inestabilidad “radiactiva” nuclear, sino por razones relativistas. Ya antes me referiría a las especies atómicas, naturales y artificiales que son de unos pocos millares; en cambio, el número de moléculas conocidas hasta ahora comprende varios millones de especímenes, aumentando continuamente el número de ellas gracias a las síntesis que se llevan a cabo en numerosos laboratorios repartidos por todo el mundo.
Una molécula es una estructura con individualidad propia, constituida por núcleos y electrones. Obviamente, en una molécula las interacciones deben tener lugar entre núcleos y electrones, núcleos y núcleos y electrones y electrones, siendo del tipo electromagnético.
Debido al confinamiento de los núcleos, el papel que desempeñan, aparte del de proporcionar la casi totalidad de la masa de la molécula, es poco relevante, a no ser que se trate de moléculas livianas, como la del hidrógeno. De una manera gráfica podríamos decir que los núcleos en una molécula constituyen el armazón de la misma, el esqueleto, cuya misión sería proporcionar el soporte del edificio. El papel más relevante lo proporcionan los electrones y en particular los llamados de valencia, que son los que de modo mayoritario intervienen en los enlaces, debido a que su energía es comparativamente inferior a la de los demás, lo que desempeña un importante papel en la evolución.
Desde las moléculas más sencilla, como la del hidrógeno con un total de 2 electrones, hasta las más complejas, como las de las proteínas con muchos miles de ellos, existe toda una gama, según decía, de varios millones. Esta extraordinaria variedad de especies moleculares contrasta con la de las especies nucleares e incluso atómicas.
Sin entrar en las posibles diferencias interpretativas de estas notables divergencias, señalaré que desde el punto de vista de la información, las especies moleculares la poseen en mucho mayor grado que las nucleares y atómicas.
Dejando aparte los núcleos, la información que soportan los átomos se podría atribuir a la distribución de su carga eléctrica, y en particular a la de los electrones más débilmente ligados. Concretando un poco se podría admitir que la citada información la soportan los orbitales atómicos, pues son precisamente estos orbitales las que introducen diferencias “geométricas” entre los diferentes electrones corticales.


Justamente esa información es la que va a determinar las capacidades de unión de unos átomos con otros, previo el “reconocimiento” entre los orbitales correspondientes. De acuerdo con la mecánica cuántica, el número de orbitales se reduce a unos pocos. Se individualizan por unas letras, hablándose de orbitales s, p, d, f, g, h. Este pequeño número nos proporciona una gran diversidad.
La llamada hibridación (una especie de mezcla) de orbitales es un modo de aumentar el número de mensajes, esto es, la información, bien entendido que esta hibridación ocurre en tanto y en cuanto dos átomos se preparan para enlazarse y formar una molécula.

En términos electrónicos, la información se podría considerar proporcionada por un campo de densidad eléctrica, con valles, cimas, collados, etc, es decir, curvas isoelectrónicas equivalentes formalmente a las de nivel en topografía. Parece razonable suponer que cuanto más diverso sean los átomos de una molécula, más rica y variada podrá ser su información, la información que pueda soportar.
Las macromoléculas son moléculas de enorme tamaño, es decir, que están compuestas por miles o cientos de miles de años. Pueden ser de naturaleza biológica, resultado de los procesos que ocurren en los organismos vivientes, o bien sintéticas, producidas por el Ser humano en laboratorios químicos o biológicos.
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos.
C .
.
La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.
El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor.
Emilio silvera V.
Mar
9
Las estrellas nos trajeron aquí 2ª parte
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Astrofísica ~
Clasificado en Astrofísica ~
 Comments (0)
Comments (0)

El título “las estrellas nos trajeron aquí” está referido a que prácticamente todos los elementos de nuestro cuerpo /excepto el hidrógeno), se forjaron en las estrellas que explotaron hacfe ahora miles de millones de años.

Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
Hablemos de cuerpos.

Me referiré en primer lugar a los que constituyen nuestro entorno ordinario, que sería todo el entorno que abarca nuestro planeta. En segundo lugar considerare los demás cuerpos y objetos del universo. El análisis de muestras de esos diversos cuerpos ha puesto de manifiesto que, en función de la composición, los cuerpos pueden ser simples y compuestos. Los primeros son, precisamente, los llamados elementos químicos, a las que el insigne Lavoisier (conocido como padre de la química), consideró como el último término a que se llega mediante la aplicación del análisis químico.
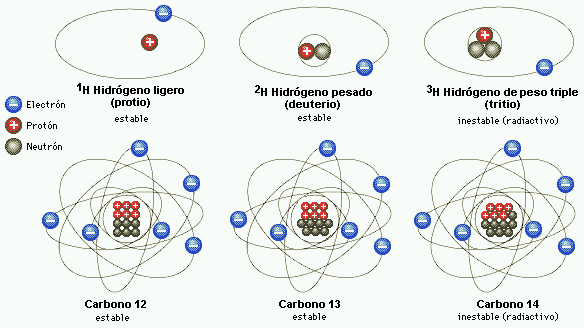
Hoy sabemos que son colectividades de átomos isotópicos.

La mayoría de ellos son sólidos y se encuentran en la naturaleza (nuestro entorno terráqueo) en estado libre o en combinación química con otros elementos, formando los diversos minerales.
La ordenación de los iones en las redes se manifiesta externamente en multitud de formas y colores. No obstante debo señalar que, aun siendo abundante esta variedad, no es tan rica como la que corresponde a los cuerpos vivos, tanto animales como vegetales. La explicación se basa en que el número de especímenes moleculares y su complejidad son mucho mayores que en el reino inorgánico.


Sería conveniente, salir al paso de una posible interpretación errónea. Me refiero a que pudiera pensarse que los reinos que acabamos de mencionar constituyen clases disyuntas, esto es, sin conexión mutua. Y no lo digo porque esté considerando el hecho de que el carbono forma compuestos inorgánicos y orgánicos (lo que también hace el silicio), sino porque haya existido, y aún pueda existir, una conclusión, mejor conexión evolutiva del mundo inorgánico y el viviente que no se puede descartar, de hecho yo particularmente estoy seguro de ello. Estamos totalmente conectados con los ríos, las montañas y los valles, con la tierra que pisamos, el aire que respiramos y con todo el resto del universo del que formamos parte.
La teoría de Cairns Smith considera que el eslabón entre ambos mundos se halla localizado en los microcristales de arcilla. Mi teoría particular es que no hay eslabón perdido en dicha conexión, sino que es el tiempo el que pone en cada momento una u otra materia en uno u otro lugar. Ahora nos ha tocado estar aquí como ser complejo, pensante y sensitivo. El eón que viene nos puede colocar formando parte de un enorme árbol, de un monte, o simplemente estar reposando como fina arena en el lecho de un río. Sin dudarlo, J. M. y P. formarán parte de un hermoso jardín perfumado y lleno de aromas que la brisa regalará a los que pasen cerca de allí.
El granito, por ejemplo, consiste básicamente en una mezcla de tres cuerpos compuestos: cuarzo, mica y feldespato. ¿Quién puede decir hoy lo que seremos mañana?
En todos los cuerpos que hemos estado considerando hasta ahora, las moléculas, los átomos o los iones se hallan situados en los nudos de la correspondiente red, así que, los electrones de esos individuos se encuentran también localizados en el entorno inmediato de esos lugares. Podríamos decir que la densidad electrónica es una función periódica espacial, lo que significa que al recorrer la red siguiendo una determinada dirección irían apareciendo altibajos, es decir, crestas y valles de la densidad electrónica.
La estructura de los cuerpos metálicos, así como las aleaciones, merecen una consideración especial. La estructura de los metales y aleaciones difiere de la de los demás cuerpos en un aspecto muy importante que consideraré a continuación.

Me refiero a que en los cuerpos metálicos existe una deslocalización de los electrones que están menos fuertemente enlazados en los correspondientes núcleos, es decir, de los electrones de valencia.
Vamos a precisar un poco. Supongamos, para fijar las ideas, que tenemos un trozo de plata metálica pura. En los nudos de la red correspondientes los átomos han perdido su electrón de valencia, pero ocurre que cada uno de estos electrones forma una colectividad que se halla desparramada o dispersa por todo el sólido. Una primera imagen de esta situación fue establecida por el gran físico italiano Enrico Fermi, por lo que se habla de un gas electrónico, llamado también de Fermi, que llenaría los espacios libres, es decir, no ocupados por los iones metálicos.

Este gas electrónico es el responsable de las propiedades metálicas, tales como el brillo, conductibilidades eléctrica y térmica, etc. La aplicación de la mecánica cuántica a la descripción del estado metálico conduce a la obtención del mapa de la densidad electrónica, o como decía antes, a las características de la información correspondiente.
Sin entrar en detalles que desviarían nuestra atención hacia otros conceptos fuera de los límites de lo que ahora estoy pretendiendo, utilizaré el mismo lenguaje que para las estructuras de núcleos y átomos.
Recordemos que en la sociedad de los nucleones y electrones existen las relaciones verticales y las de estratificación, que se manifiestan en las capas y subcapas. En el caso de los metales tendríamos una colectividad de núcleos, arropados con sus capas cerradas, ocupando los nudos de la red; únicamente los electrones de valencia de cada átomo forman la colectividad del gas electrónico.
La pregunta que nos debemos hacer es: ¿estos electrones, en número igual por lo menos al de los átomos, se hallan estratificados? La respuesta es que sí. Existe una estratificación de estos electrones en las llamadas bandas. El concepto de banda energética resulta de la consideración simultánea de dos aspectos: la cuantización energética (o la estratificación de los niveles energéticos en los átomos) y el grandísimo número de electrones existentes. Este colectivo no podría ubicarse en un número finito y escaso de niveles. Esta dificultad queda soslayada si se admite que cada uno de esos niveles atómicos de los n átomos que forman el cuerpo se funde en otros tantos niveles de cierta anchura donde ya pueden alojarse los electrones disponibles.
Esa fusión de los niveles atómicos da lugar a las bandas. Esta imagen equivaldría a considerar un metal como un átomo gigante en el que los niveles energéticos poseyeran una anchura finita.
En cuanto a la información que puede soportar un metal, podríamos señalar que sería parecida a la del correspondiente átomo, pero mucha más extendida espacialmente. Una información puntual, la del átomo, daría paso a otra espacial, si bien vendría a ser una mera repetición periódica de aquella.
¿Y los cuerpos que pueblan el resto del universo?
Cuando un cuerpo sobrepasa unas determinadas dimensiones, aparece algo que conocemos como fuerza gravitatoria y que se deja sentir en la forma que todos conocemos y que da lugar primeramente a la fusión de los diversos materiales que forman los cuerpos.
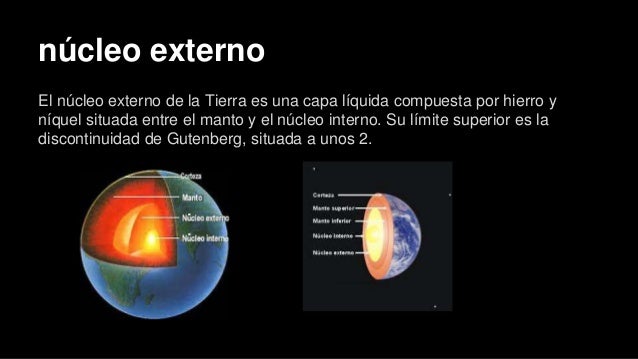
Así, por ejemplo, en el cuerpo que llamamos Tierra, la presión crece con la profundidad, por lo que a partir de un determinado valor de ésta, aparece el estado líquido y con él una estratificación que trata de establecer el equilibrio hidrostático.
Dentro de nuestro sistema planetario se distinguen los planetas rocosos, hasta Marte y meteoritos inclusive, y el resto de ellos, desde Júpiter en adelante, incluido este. Estos últimos difieren esencialmente de los primeros en su composición. Recuérdese que la de Júpiter es mucho más simple que la de los planetas rocosos. Consta fundamentalmente de hidrógeno, helio, agua, amoniaco y metano, con un núcleo rocoso en su interior. El hidrógeno que rodea a este núcleo se encuentra en forma de hidrógeno atómico sólido.
También la composición del Sol (y todas las estrellas que brillan) es más simple que la de los planetas rocosos, su estado físico es el de plasma y su contenido está reducido (mayormente) a hidrógeno y helio. Más variedad de materiales existe en las estrellas supernovas, donde el primitivo hidrógeno ha evolucionado de la manera que expliqué en otra parte de este trabajo.

En cuanto a los derechos de la evolución estelar, enanas blancas, estrellas de neutrones y agujeros negros, señalaré que la composición de la primera es sencilla en cuanto al numero de “elementos” constituyentes; la segunda ya lo indica su propio nombre, constan de nucleones, particularmente neutrones que están fuertemente empaquetados (muy juntos) por la gravedad. Una estrella de neutrones puede tener una densidad superior a la del agua, en millones de veces y del mismo orden que la de los núcleos atómicos. El agujero negro es un fenómeno aparte, su inmensa fuerza gravitatoria es tal que ni la luz puede escapar de ella, es decir, su velocidad de escape es superior a 300.000 Km/s, y como según la relatividad nada es en nuestro universo superior en velocidad a la luz, resulta que nada podrá escapar de un agujero negro.

Menos mal que nadie ha visitado un agujero negro. No podría haber regresasdo para contarnos los que allí ocurre. Sin embargo, sabemos que…
Allí dentro, en el interior del agujero negro, no existen ni el tiempo ni el espacio; es como un objeto que estando en nuestro universo (deja sentir su fuerza gravitatoria y engulle estrellas), al mismo tiempo no está aquí.
Desde el comienzo de este trabajo estoy tratando de relacionar el universo, la materia y la consciencia, es por ello que me he entretenido en dar tantas explicaciones tratándo de hacerme comprender, si lo he conseguido o no será cuestión de que ustedes emitan su veredicto.
Emilio Silvera V.
















 Totales: 86.102.971
Totales: 86.102.971 Conectados: 72
Conectados: 72