Ene
27
¿El núcleo del átomo? ¡Una maravilla de la Naturaleza!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (1)
Comments (1)

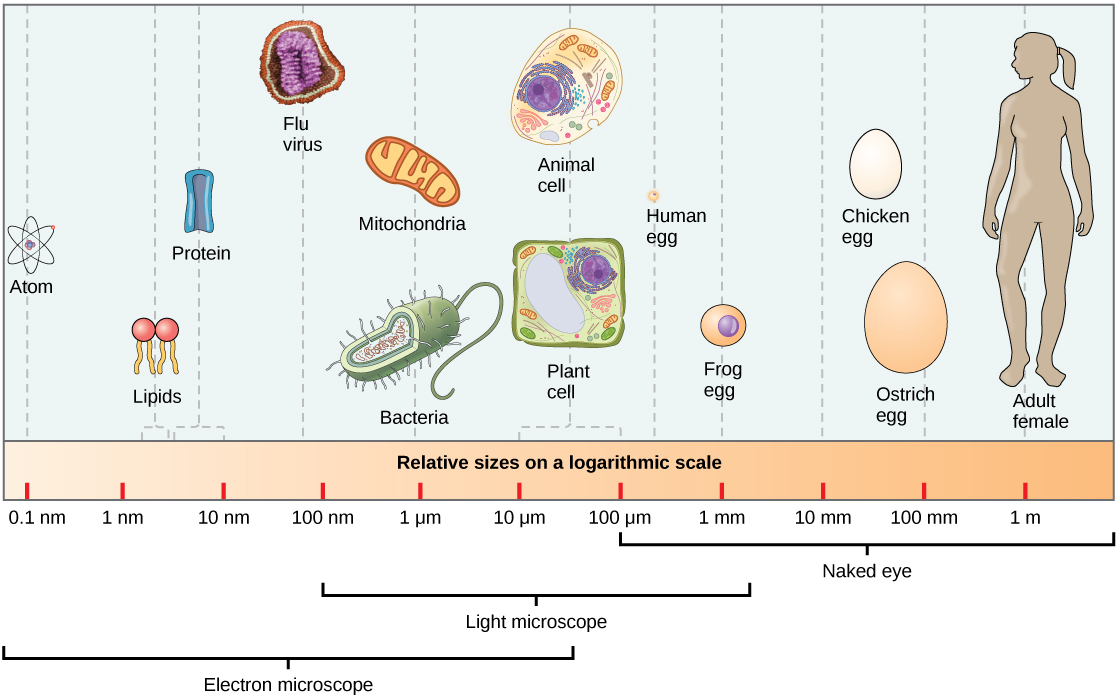
Las partículas del núcleo atómico. Protón y neutrón (sin olvidar los tripletes de Quarks que los constituyen y los Bosones intermediarios de la fuerza nuclear fuerte (Los Gluones)
En 1920 (Rutherford) descdubrió las partículas positivas que forman los átomos, los protones.

Por lo tanto en los núcleos de los átomos hay unas partículas positivas que se llaman protones. En el hidrógeno solo hay una partícula ya que recordemos su masa era casi la misma.

Se comprobó que el número de protones es una característica especial de cada elemento químico, ya que todos los átomos del mismo elemento tienen el mismo número de protones. Se llama número atómico (Z) al número de protones que tienen los átomos de un elemento químico. A cada elemento químico le corresponde un número atómico desde 1 hasta 106.
Todavía tenemos que buscar otras partículas en el núcleo atómico. La masa de los protones de un núcleo es mucho menor que la masa del núcleo.

Cada elemento químico se caracteriza por el número de protones de su núcleo, que se denomina número atómico (Z). Así, el hidrógeno ( 1H) tiene un protón, el carbono ( 6C) tiene 6 protones y el oxígeno ( 8O) tiene 8 protones en el núcleo.
El número de neutrones del núcleo puede variar. Casi siempre hay tantos o más neutrones que protones. La masa atómica(A) se obtiene sumando el número de protones y de neutrones de un núcleo determinado.
Un mismo elemento químico puede estar constituído por átomos diferentes, es decir, sus números atómicos son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento en cuestión. Isótopos significa “mismo lugar“, es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.
isótopos del Hidrógeno

isótopos del Carbono

Desde 1918 estaba probado que existían los isótopos. Estos, eran átomos que tenían propiedades químicas iguales (parecían elementos iguales, por tanto), tenían el mismo número atómico, pero sus masas atómicas eran diferentes. En el núcleo debían existir partículas neutras que contribuyeran a la masa pero no tuvieran carga eléctrica.



La curiosidad acerca del tamaño y masa del átomo atrajo a cientos de científicos durante un largo período en el que la falta de instrumentos y técnicas apropiadas impidió lograr respuestas satisfactorias. Con posterioridad se diseñaron numerosos experimentos ingeniosos para determinar el tamaño y peso de los diferentes átomos.
El átomo más ligero, el de hidrógeno, tiene un diámetro de aproximadamente 10-10 m (0,0000000001 m) y una masa alrededor de 1,7 x 10-27 kg (la fracción de un kilogramo representada por 17 precedido de 26 ceros y una coma decimal).


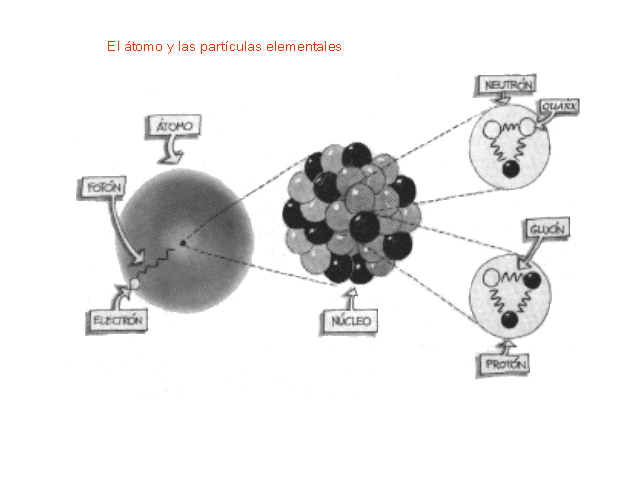
Como no es el objeto del trabajo, no hablaremos hoy de los Quarks, y, simplemente diremos que en la naturaleza no se encuentran quarks aislados. Estos siempre se encuentran en grupos, llamados Hadrones. de dos o tres quarks, conocidos como mesones y bariones respectivamente. Esto es una consecuencia directa del confinamiento de color. En el año 2003 se encontró evidencia experimental de una nueva asociación de cinco quarks, los Pentaquarks, cuya evidencia, en principio controvertida , fue demostrada gracias al Colisionador de Partículas LHC en el pasado Julio de 2.015.

Pero sigamos con lo que nos ocupa y veámos que los Quarks están confinados dentro de los nucleones (protones y neutrones) donde la fuerza fuerte les retiene y nos los deja que se vayan alejando más de lo debido como se explica en el cuadro de arriba.
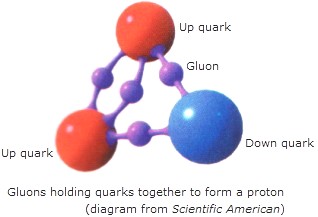
Dentro del nucleo se desatan las fuerzas de la Naturaleza, la que conocemos como fuerza nuclear fuerte, la más potente de las cuatro fuerzas fundamentales que, intermediada por otras partículas de la familia de los Bosones, los Gluones, no dejan que los Quarks se alejen y son retenidos allí, dentro de los nucleones donde tienen su función de conformar los hadrones másicos del núcleo que le aporta la materia al átomo.
Los Gluones, son las partículas intermediarias de la fuerza fuerte, y, de la misma manera, existen otros Bosones encargados de mediar en las otras fuerzas conocidas de la Naturaleza: El Fotón para los fenómenos electromagnéticos, el Gravitón (no encontrado aún) para la fuerza de Gravedad, y, los W+, W–y Zº para la fuerza nuclear débil. Los Gluones se encargan de la fuerza nuclear fuerte para el que el núcleo del átomo sea posible
Lo cierto es que, el núcleo atómico está cargado positivamente y, tal carga, hace la llamada para que, un enjambre de electrones, con cargas negativas, vengan a rodear el núcleo atómico y, de esa manera, queda estabilidado el átomo, ese pequeño objeto que conforma todas las cosas hechas de materia.
Así, los electrones que rodea el núcleo, con su carga eléctrica negativa que complementa la positiva de los protones y hace estable al átomo; una masa de solamente 1/1.836 de la del núcleo más ligero (el del hidrógeno). Y, sin embargo, la importancia del electrón es vital en el universo.
Repasando todo esto, no puedo dejar de recordar aquellas palabras que el físico Freeman Dyson escribió:
“Cuando miramos en el universo e identificamos los muchos accidentes de la física y la astronomía que han colaborado en nuestro beneficio, casi parece que el universo debe haber sabido, en cierto sentido, que nosotros íbamos a venir“.
Fijaros en el hecho cierto de que, si la carga del electrón, o, la masa del protón, variaran aunque sólo fuese una diezmillonésima parte… ¡La vida no podría existir en el Universo! Estamos hechos de átomos y, con tal cambio, éstos nunca se habrían podido conformar.
emilio silvera.
Nov
21
¿El núcleo del átomo? ¡Una maravilla de la Naturaleza!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (0)
Comments (0)

Las partículas del núcleo atómico. Protón y neutrón.
En 1920 (Rutherford) descdubrió las partículas positivas que forman los átomos, los protones.

Por lo tanto en los núcleos de los átomos hay unas partículas positivas que se llaman protones. En el hidrógeno solo hay una partícula ya que recordemos su masa era casi la misma.

Se comprobó que el número de protones es una característica especial de cada elemento químico, ya que todos los átomos del mismo elemento tienen el mismo número de protones. Se llama número atómico (Z) al número de protones que tienen los átomos de un elemento químico. A cada elemento químico le corresponde un número atómico desde 1 hasta 106.
Todavía tenemos que buscar otras partículas en el núcleo atómico. La masa de los protones de un núcleo es mucho menor que la masa del núcleo.

Cada elemento químico se caracteriza por el número de protones de su núcleo, que se denomina número atómico (Z). Así, el hidrógeno ( 1H) tiene un protón, el carbono ( 6C) tiene 6 protones y el oxígeno ( 8O) tiene 8 protones en el núcleo.
El número de neutrones del núcleo puede variar. Casi siempre hay tantos o más neutrones que protones. La masa atómica (A) se obtiene sumando el número de protones y de neutrones de un núcleo determinado.
Un mismo elemento químico puede estar constituído por átomos diferentes, es decir, sus números atómicos son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento en cuestión. Isótopos significa “mismo lugar“, es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.
isótopos del Hidrógeno

isótopos del Carbono

Desde 1918 estaba probado que existían los isótopos. Estos, eran átomos que tenían propiedades químicas iguales (parecían elementos iguales, por tanto), tenían el mismo número atómico, pero sus masas atómicas eran diferentes. En el núcleo debían existir partículas neutras que contribuyeran a la masa pero no tuvieran carga eléctrica.



La curiosidad acerca del tamaño y masa del átomo atrajo a cientos de científicos durante un largo período en el que la falta de instrumentos y técnicas apropiadas impidió lograr respuestas satisfactorias. Con posterioridad se diseñaron numerosos experimentos ingeniosos para determinar el tamaño y peso de los diferentes átomos.
El átomo más ligero, el de hidrógeno, tiene un diámetro de aproximadamente 10-10 m (0,0000000001 m) y una masa alrededor de 1,7 x 10-27 kg (la fracción de un kilogramo representada por 17 precedido de 26 ceros y una coma decimal).




Como no es el objeto del trabao, no hablaremos hoy de los Quarks, y, simplemente diremos que en la naturaleza no se encuentran quarks aislados. Estos siempre se encuentran en grupos, llamados Hadrones. de dos o tres quarks, conocidos como mesones y bariones respectivamente. Esto es una consecuencia directa del confinamiento de color. En el año 2003 se encontró evidencia experimental de una nueva asociación de cinco quarks, los Pentaquarks, cuya evidencia, en principio controvertida , fue demostrada gracias al Colisionador de Partículas LHC en el pasado Julio de 2.015.

Pero sigamos con lo que nos ocupa y veámos que los Quarks están confinados dentro de los nucleones (protones y neutrones) donde la fuerza fuerte les retiene y nos los deja que se vayan alejando más de lo debido como se explica en el cuadro de arriba.

Dentro del nucleo se desatan las fuerzas de la Naturaleza, la que conocemos como fuerza nuclear fuerte, la más potente de las cuatro fuerzas fundamentales que, intermediada por otras partículas de la familia de los Bosones, los Gluones, no dejan que los Quarks se alejen y son retenidos allí, dentro de los nucleones donde tienen su función de conformar los hadrones másicos del núcleo que le aporta la materia al átomo.
Los Gluones, son las partículas intermediarias de la fuerza fuerte, y, de la misma manera, existen otros Bosones encargados de mediar en las otras fuerzas conocidas de la Naturaleza: El Fotón para los fenómenos electromagnéticos, el Gravitón (no encontrado aún) para la fuerza de Gravedad, y, los W+, W– y Zº para la fuerza nuclear débil.

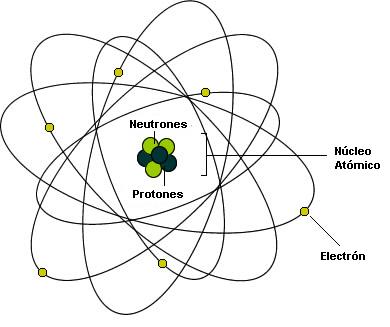
Lo cierto es que, el núcleo atómico está cargado positivamente y, tal carga, hace la llamada para que, un enjambre de electrones, con cargas negativas, vengan a rodear el núcleo atómico y, de esa manera, queda estabilidado el átomo, ese pequeño objeto que conforma todas las cosas hechas de materia.
Así, los electrones que rodea el núcleo, con su carga eléctrica negativa que complementa la positiva de los protones y hace estable al átomo; una masa de solamente 1/1.836 de la del núcleo más ligero (el del hidrógeno). Y, sin embargo, la importancia del electrón es vital en el universo.
Repasando todo esto, no puedo dejar de recordar aquellas palabras que el físico Freeman Dyson escribió:

“Cuando miramos en el universo e identificamos los muchos accidentes de la física y la astronomía que han colaborado en nuestro beneficio, casi parece que el universo debe haber sabido, en cierto sentido, que nosotros íbamos a venir“.
Fijaros en el hecho cierto de que, si la carga del electrón, o, la masa del protón, variaran aunque sólo fuese una diezmillonésima parte… ¡La vida no podría existir en el Universo! Estamos hechos de átomos y, con tal cambio, éstos nunca se habrían podido conformar.
emilio silvera.
Nov
1
Los átomos, el núcleo atómico
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (0)
Comments (0)

Es tan pequeño que ni lo podemos ver con el ojo desnudo, nos valemos de los microscopios electrónicos para poder saber de ellos, y, sin embargo, si me dieran a escoger la mayor maravilla del Universo, tendría mis dudas entre los átomos y el cerebro. Pero creo que, al final, sin dudarlo, escogería ésta ¡Los átomos!
El número de protones en el núcleo define a qué elemento químico pertenece el átomo: por ejemplo, todos los átomos de cobre contienen 29 protones. El número de neutrones define el isótopo del elemento. El número de electrones influye en las propiedades magnéticas de un átomo.

Mucho ha tenido que trasminar la Mente Humana para llegar al fondo de los componentes de la materia que, como todos sabemos ahora, están conformadas de moléculas hechas de átomos que, a su vez, están hechos de partículas subatómicas unas más elementales que otras que, dentro del núcleo y fuera de él, hacen el conjunto que denominamos átomos.

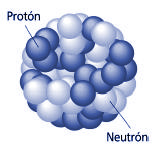
El núcleo atómico está cargado positivamente al tener allí situados a los protones. Los neutrones no tienen carga y éstas dos partículas de la familia de los Hadrones en su rama bariónica, cuando están dentro del núcleo se suelen llamar nucleones. Lo curioso del caso es que, dentro de ellos, partículas más pequeñas de la familia Quarks, se han juntado en tripletes para conformarlos, es decir, un protón está hech0 por dos quarks up y un quark down, mientras que un neutrón, está hecho por dos qurks down y un quarks up.

Pero lo m´ças curioso del caso es que, los Quarks dentro de los protones y los neutrones están confinados, no pueden separarse y son sujetados por 8 partículas de la familia de los Bosones que se llaman Gluones que, son los intermediarios de la fuerza nuclear fuerte, la más potente de todas las fuerzas fundamentales de la Naturaleza. Esa fuerza, funciona al contrario que las otras tres, es decir, aumenta con la distancia. Se comporta como un muelle de acero que, cuanto más lo estiramos más resistencia opone.

Representación aproximada del átomo de Helio. en el núcleo los protones están representados en rojo y los neutrones en azul. En la realidad el núcleo también es simétricamente esférico. El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo.
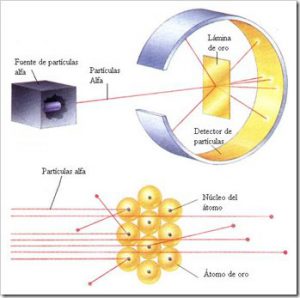
La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
El Experimento de Rutherford. En 1911 se realizó en Manchester una experiencia encaminada a corroborar el modelo atómico de Thomson. Fué llevada a cabo por Geiger, Marsden y Rutherford, y consistía en bombardear con partículas alfa (núcleos del gas helio) una fina lámina de metal.

Una imagen precisa del núcleo del carbono-14 debe tener en cuenta tanto las interacciones entre parejas de protones y neutrones (fuerza a dos cuerpos, izquierda), como las interacciones entre tres nucleones (fuerzas a tres cuerpos, derecha).

Lo cierto es que, estos “personajillos” tienen una imnesa importancia en todo lo que se cuece en el Universo, ya que, sin ellos, no existirían las estrellas ni los mundos, ni las galaxias, ni las Nebulosas, ni ninguno de los objetos que captan nuestros telescopios en el inconmensurable Cosmos. ¡Ah! Tampoco nosotros podríamos existir si en estos personajes se dieran algunos cambios. Imaginaros que la masa del protón decrece en una diezmillonésima parte, o, que lo mismo le pudiera pasar a la carga del electrón… ¡Nosotros no existiríamos!
Interacciones eléctricas entre protones y electrones
Antes del experimento de Rutherford la comunidad científica aceptaba el modelo atómico de Thomson, situación que varió después de la experiencia de Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positívamente rodeada de una nube de carga negativa.
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas. Este modelo tiene una dificultad proveniente del hecho de que una partícula cargada acelerada, como sería necesario para mantenerse en órbita, radiaría radiación electromagnética, perdiendo energía.
Para aclarar el panorama y la confusión que sobre el átomo y el núcleo atómico existía, tuvo que llegar el gran físico Murray Gell-Mann, que fue quien por primera vez habló de los Quarks. Se le otorgó el Premio Nobel de Física en 1969 por sus descubrimientos sobre partículas elementales. La teoría de Gell-Mann aportó orden al caos que surgió al descubrirse cerca de 100 partículas en el interior del núcleo atómico. Esas partículas, además de los protones y neutrones, estaban formadas por otras partículas elementales llamadas Quarks. Los quarks se mantienen unidos gracias al intercambio de Gluones. Junto con otros investigadores construyó la teoría cuántica de quarks y gluones, llamada Cromodinámica cuántica.
Sí, ¡Todo lo grande está hecho de cosas pequeñas!
Oct
1
¡El Núcleo del Átomo!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (0)
Comments (0)

Representación aproximada del átomo de Helio, en el núcleo los protones están representados en rojo y los neutrones en azul. En la realidad el núcleo también es simétricamente esférico. A pesar de su pequeñez, es de una complejidad enorme todo lo que allí está presente.

Los experimentos llevados a cabo en 1911 bajo la dirección de Ernest Rutherford modificaron las ideas existentes sobre la naturaleza del átomo. Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (núcleos de helio) procedentes de un elemento radiactivo.
El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo. Un átomo es la unidad constituyente más pequeña de la materia que tiene las propiedades de un elemento químico. Cada sólido, líquido, gas y plasma se compone de átomos neutros o ionizados. Los átomos son muy pequeños; los tamaños típicos son alrededor de 100 pm (diez mil millonésima parte de un metro)

Está formado por protones y neutrones ( partículas de la familia de los Hadrones de la clase Barión que dentro del núcleo, son denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes). La cantidad de protones en el núcleo (el número atómico), determina el elemento químico al que pertenece. Los núcleos atómicos no necesariamente tienen el mismo número de neutrones, ya que átomos de un mismo elemento pueden tener masas diferentes, es decir son isótopos del elemento.

Cada elemento químico se caracteriza por el número de protones de su núcleo, que se denomina número atómico (Z). Así, el hidrógeno ( 1H) tiene un protón, el carbono ( 6C) tiene 6 protones y el oxígeno ( 8O) tiene 8 protones en el núcleo.
El número de neutrones del núcleo puede variar. Casi siempre hay tantos o más neutrones que protones. La masa atómica (A) se obtiene sumando el número de protones y de neutrones de un núcleo determinado.
Un mismo elemento químico puede estar constituído por átomos diferentes, es decir, sus números atómicos son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento en cuestión. Isótopos significa “mismo lugar“, es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.
- Si a un átomo se le añade un protón, se convierte en un nuevo elemento químico
- Si a un átomo se le añade un neutrón, se convierte en un isótopo de ese elemento químico.

Los isótopos del carbono son 116C (6 protones y cinco neutrones), 126C (6 protones y seis neutrones), 136C (6 protones y siete neutrones) y 146C (6 protones y ocho neutrones).

La existencia del núcleo atómico fue deducida del experimento de Rutherford (segunda imagen expuesta) donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
Diagrama de Segrè, en rojo los núcleos estables, en otros colores los núcleos inestables coloreados según el período de desintegración. Obsérvese que un ligero exceso de neutrones favorece la estabilidad en átomos pesados.
Los núcleos atómicos son mucho más pequeños que el tamaño típico de un átomo (entre 10 mil y 100 mil veces más pequeños). Además contienen más del 99% de la masa con lo cual la densidad másica del núcleo es muy elevada. Los núcleos atómicos tienen algún tipo de estructura interna, por ejemplo los neutrones y protones parecen estar orbitando unos alrededor de los otros, hecho que se manifiesta en la existencia del momento magnético nuclear. Sin embargo, los experimentos revelan que el núcleo se parece mucho a una esfera o elipsoide compacto de 10-15 m (= 1 fm), en el que la densidad parece prácticamente constante. Naturalmente el radio varía según el número de protones y neutrones, siendo los núcleos más pesados y con más partículas algo más grandes.
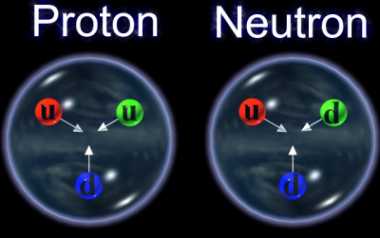
Aquí nos tendríamos que parar un poco y explicar que, tanto los protones como los Neutrones, partículas que son Hadrones, están conformados, a su vez, por tripletes de Quarks, es decir, un Protón está hecho de tres Quarks, 2 quarks up y 1 Quark Down, mientras que, un Neutrón, está hecho de 2 Quarks Down y 1 Quark up.


Los Quarks están confinados dentro de los nucleones, y sujetos por la fuerza nuclear fuerte que, dicho sea de paso, funciona al contrario de las otras fuerzas fundamentales, cuando más lejos están los objetos, más fuerte es la fuerza, se comporta como si de un muelle de acero se tratara que, cuanto más se estira más resistencia opone.

Si los Quarks están juntos dentro de los nucleones, se mueven con facilidad y nada les impide cierta libertad (libertad asintótica), sin embargo, si tratan de separse los unos de los otros, entre en escena la fuerza fuerte y, mediada por ocho partículas mediadoras de dicha fuerza, los Gluones, los retienen e impiden que se muevan o desplacen más de lo conveniente.
Así las coass, tenemos que en el “simple” núcleo de los átomos, están presentes objetos y huegan fuerzas que ni podíamos imaginar. No se trata sólo de un núcleo pequeño, infinitesimal con los tamaños típicos que son alrededor de 100 pm (diez mil millonésima parte de un metro), sin embargo, son de una importancia capital para que la materia exista, y los mundos, y las estrellas, las montañas, los océanos, las Galaxiass, y, ¡nosotros!
Como digo tantas veces: Todo lo grande está hecho de cosas pequeñas.
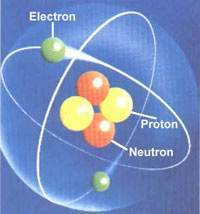
Así que ahora sabemos que la pequeña región central del átomo donde se encuentran distribuidos los neutrones y protones, partículas fundamentales del núcleo, que reciben el nombre de nucleones. La estabilidad del núcleo no puede explicarse por su acción eléctrica. Al contrario, la repulsión existente entre los protones produciría su desintegración. El hecho de que en el núcleo existan neutrones y protones es un indicador de que debe existir otra interacción más fuerte que la electromagnética que no está directamente relacionada con cargas eléctricas y que es mucho más intensa. Esta interacción se llama interacción nuclear fuerte y es la que predomina en el núcleo y, hasta la fecha, la más fuerte conocida en el universo.
La fuerza nuclear fuerte es una de las cuatro fuerzas que el modelo estándar actual de la Física establece para explicar las interacciones entre las partículas conocidas.

Contrariamente a las fuerzas de gravedad y electromagnética que tienen un alcance infinito, la fuerza nuclear fuerte es de muy corto alcance: su radio de acción es menor que una billonésima de milímetro, 10-13mm, ligeramente menor que el tamaño del núcleo. Como su alcance es menor que el radio del núcleo, no interactúa con otros núcleos cercanos. Si no fuera así, todos los núcleos del universo se habrían colapsado para formar un gran conglomerado de masa nuclear.
Si un núcleo atómico es bombardeado con un haz de neutrones, gana neutrones adicionales y se hace más grande. Llega un momento en que la fuerza nuclear fuerte no tiene el alcance suficiente para mantener al núcleo unido. Como resultado, el núcleo se parte en dos, generando una gran cantidad de energía.

En la teoría cuántica de campos, a cada tipo de interacción le corresponde una familia de partículas portadoras de la interacción.
Las partículas que transportan la fuerza fuerte nuclear que interactúa entre los quarks se denominan gluones.
La fuerza nuclear fuerte se deduce del requisito de que las ecuaciones que describen a los quarks deben ser las mismas, independientemente de cómo se elija la definición de los colores de los quarks. La mecánica cuántica explica bastante bien todos estos fenómenos asociados a los núcleos atómicos y los átomos, otro día avanzaremos algo más en las explicaciones.
emilio silvera
Nov
13
¿El núcleo del átomo? ¡Una maravilla de la Naturaleza!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (3)
Comments (3)

Las partículas del núcleo atómico. Protón y neutrón.
En 1920 (Rutherford) descdubrió las partículas positivas que forman los átomos, los protones.

Por lo tanto en los núcleos de los átomos hay unas partículas positivas que se llaman protones. En el hidrógeno solo hay una partícula ya que recordemos su masa era casi la misma.

Se comprobó que el número de protones es una característica especial de cada elemento químico, ya que todos los átomos del mismo elemento tienen el mismo número de protones. Se llama número atómico (Z) al número de protones que tienen los átomos de un elemento químico. A cada elemento químico le corresponde un número atómico desde 1 hasta 106.
Todavía tenemos que buscar otras partículas en el núcleo atómico. La masa de los protones de un núcleo es mucho menor que la masa del núcleo.

Cada elemento químico se caracteriza por el número de protones de su núcleo, que se denomina número atómico (Z). Así, el hidrógeno ( 1H) tiene un protón, el carbono ( 6C) tiene 6 protones y el oxígeno ( 8O) tiene 8 protones en el núcleo.
El número de neutrones del núcleo puede variar. Casi siempre hay tantos o más neutrones que protones. La masa atómica (A) se obtiene sumando el número de protones y de neutrones de un núcleo determinado.
Un mismo elemento químico puede estar constituído por átomos diferentes, es decir, sus números atómicos son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento en cuestión. Isótopos significa “mismo lugar“, es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.
isótopos del Hidrógeno

isótopos del Carbono

Desde 1918 estaba probado que existían los isótopos. Estos, eran átomos que tenían propiedades químicas iguales (parecían elementos iguales, por tanto), tenían el mismo número atómico, pero sus masas atómicas eran diferentes. En el núcleo debían existir partículas neutras que contribuyeran a la masa pero no tuvieran carga eléctrica.



La curiosidad acerca del tamaño y masa del átomo atrajo a cientos de científicos durante un largo período en el que la falta de instrumentos y técnicas apropiadas impidió lograr respuestas satisfactorias. Con posterioridad se diseñaron numerosos experimentos ingeniosos para determinar el tamaño y peso de los diferentes átomos.
El átomo más ligero, el de hidrógeno, tiene un diámetro de aproximadamente 10-10 m (0,0000000001 m) y una masa alrededor de 1,7 x 10-27 kg (la fracción de un kilogramo representada por 17 precedido de 26 ceros y una coma decimal).





Como no es el objeto del trabao, no hablaremos hoy de los Quarks, y, simplemente diremos que en la naturaleza no se encuentran quarks aislados. Estos siempre se encuentran en grupos, llamados Hadrones. de dos o tres quarks, conocidos como mesones y bariones respectivamente. Esto es una consecuencia directa del confinamiento de color. En el año 2003 se encontró evidencia experimental de una nueva asociación de cinco quarks, los Pentaquarks, cuya evidencia, en principio controvertida , fue demostrada gracias al Colisionador de Partículas LHC en el pasado Julio de 2.015.

Pero sigamos con lo que nos ocupa y veámos que los Quarks están confinados dentro de los nucleones (protones y neutrones) donde la fuerza fuerte les retiene y nos los deja que se vayan alejando más de lo debido como se explica en el cuadro de arriba.

Dentro del nucleo se desatan las fuerzas de la Naturaleza, la que conocemos como fuerza nuclear fuerte, la más potente de las cuatro fuerzas fundamentales que, intermediada por otras partículas de la familia de los Bosones, los Gluones, no dejan que los Quarks se alejen y son retenidos allí, dentro de los nucleones donde tienen su función de conformar los hadrones másicos del núcleo que le aporta la materia al átomo.
Los Gluones, son las partículas intermediarias de la fuerza fuerte, y, de la misma manera, existen otros Bosones encargados de mediar en las otras fuerzas conocidas de la Naturaleza: El Fotón para los fenómenos electromagnéticos, el Gravitón (no encontrado aún) para la fuerza de Gravedad, y, los W+, W– y Zº para la fuerza nuclear débil.



Lo cierto es que, el núcleo atómico está cargado positivamente y, tal carga, hace la llamada para que, un enjambre de electrones, con cargas negativas, vengan a rodear el núcleo atómico y, de esa manera, queda estabilidado el átomo, ese pequeño objeto que conforma todas las cosas hechas de materia.
Así, los electrones que rodea el núcleo, con su carga eléctrica negativa que complementa la positiva de los protones y hace estable al átomo; una masa de solamente 1/1.836 de la del núcleo más ligero (el del hidrógeno). Y, sin embargo, la importancia del electrón es vital en el universo.
Repasando todo esto, no puedo dejar de recordar aquellas palabras que el físico Freeman Dyson escribió:
“Cuando miramos en el universo e identificamos los muchos accidentes de la física y la astronomía que han colaborado en nuestro beneficio, casi parece que el universo debe haber sabido, en cierto sentido, que nosotros íbamos a venir“.
Fijaros en el hecho cierto de que, si la carga del electrón, o, la masa del protón, variaran aunque sólo fuese una diezmillonésima parte… ¡La vida no podría existir en el Universo! Estamos hechos de átomos y, con tal cambio, éstos nunca se habrían podido conformar.
emilio silvera.
















 Totales: 69.213.364
Totales: 69.213.364 Conectados: 35
Conectados: 35























