Jun
22
De lo pequeño a lo grande
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en De lo pequeño a lo grande ~
Clasificado en De lo pequeño a lo grande ~
 Comments (0)
Comments (0)


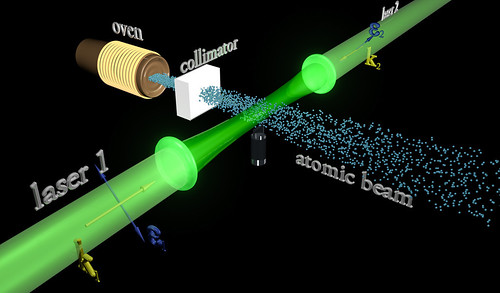
Debido al principio de exclusión de Pauli, es imposible que dos fermiones ocupen el mismo cuántico (al contrario de lo que ocurre con los bosones). La condensación Bose-Einstein es de importancia fundamental explicar el fenómeno de la superfluidez. A temperaturas muy bajas (del orden de 2×10-7º K) se formar un condensado de Bose-Einstein, en el que varios miles de átomos forman una única entidad (un superátomo). efecto ha sido observado con átomos de rubidio y litio. Como ha habréis podido suponer, la condensación Bose-Einstein es llamada así en honor al físico Satyendra Nath Bose (1.894 – 1.974) y a Albert Einstein. Así que, el principio de exclusión de Pauli tiene aplicación no sólo a los electrones, sino también a los fermiones; pero no a los bosones.
Las reglas de la mecánica cuántica tienen que ser aplicadas si queremos describir estadísticamente un sistema de partículas que obedece a reglas de ésta teoría en vez de las de la mecánica clásica. En estadística cuantica, los estados de energía se considera que están cuantizados. La estadística de Bose-Einstein se aplica si cualquier de partículas puede ocupar un estado cuántico dado. Dichas partículas (como dije antes) son los bosones que, tienden a juntarse.
Los bosones tienen un angular n h / 2p, donde n es cero o un entero y h es la constante de Planck. bosones idénticos, la función de ondas es siempre simétrica. Si solo una partícula puede ocupar un cuántico, tenemos que aplicar la estadística Fermi-Dirac y las partículas (como también antes dije) son los fermiones que tienen momento angular (n+½) h/2p y cualquier función de ondas de fermiones idénticos es siempre antisimétrica.
La mejor teoría explicar el mundo subatómico nació en 1928 cuando el teórico Paul Dirac combinó la mecánica cuántica con la relatividad especial para explicar el comportamiento del electrón. El resultado fue la mecánica cuántica relativista, que se transformó en un ingrediente primario en la teoría cuántica de campos. Con unas pocas suposiciones y ajustes ad-hoc, la teoría cuántica de campos ha probado ser suficientemente poderosa para formar la base del modelo estándar de las partículas y las fuerzas.

La relación el espín y la estadística de las partículas está demostrada por el teorema espín-estadística. En un espacio de dos dimensiones es posible que existan partículas (o cuasipartículas) con estadística intermedia entre bosones y fermiones. Estas partículas se conocen con el de aiones; para aniones idénticos la función de ondas no es simétrica (un cambio de fase de+1) o antisimétrica (un cambio de fase de -1), sino que interpola continuamente entre +1 y -1. Los aniones pueden ser importantes en el análisis del efecto Hall cuántico fraccional y han sido sugeridos como un mecanismo para la superconductividad de alta temperatura.

Resulta fácil comprender cómo un campo magnético la partícula cargada que gira, pero ya no resulta tan fácil saber por qué ha de hacer lo mismo un neutrón descargado. Lo cierto es que cuando un rayo de neutrones incide sobre un hierro magnetizado, no se comporta de la misma forma que lo haría si el hierro no estuviese magnetizado. El magnetismo del neutrón sigue siendo un misterio; los físicos sospechan que contiene cargas positivas y negativas equivalente a cero, aunque por alguna razón desconocida, logran crear un campo magnético cuando gira la partícula.

Particularmente creo que, si el neutrón masa, si la masa es energía (E = mc2), y si la energía es electricidad y magnetismo (según Maxwell), el magnetismo del neutrón no es tan extraño, sino que es un aspecto de lo que en realidad es materia. La materia es la luz, la energía, el magnetismo, en definitiva, la fuerza que reina en el universo y que está presente de una u otra forma en todas partes (aunque no podamos verla).
Sea fuere, la rotación del neutrón nos da la respuesta a esas preguntas:

La primera demostración efectiva de antimateria se tuvo en Brookhaven en 1.965
¿Qué es el antineutrón? Pues, simplemente, un neutrón cuyo movimiento rotatorio se ha invertido; su polo sur magnético, por decirlo así, está arriba y no abajo. En realidad, el protón y el antiprotón, el electrón y el positrón, muestran exactamente el mismo fenómeno de los polos invertidos. Es indudable que las antipartículas pueden combinarse para formar la antimateria, de la misma que las partículas corrientes forman la materia ordinaria.
La primera demostración efectiva de antimateria se tuvo en Brookhaven en 1.965, donde fue bombardeado un blanco de berilio con 7 protones BeV y se produjeron combinaciones de antiprotones y antineutrones, o sea, un antideuterón. entonces se ha producido el antihelio 3, y no cabe duda de que se podría crear otros antinúcleos más complicados aún si se abordara el problema con más interés.
Pero, ¿existe en realidad la antimateria? ¿Hay masas de antimateria en el universo? Si las hubiera, no revelarían su presencia a cierta distancia. Sus efectos gravitatorios y la luz que produjeran serían idénticos a los de la materia corriente. Sin embargo, cuando se encontrasen las masas de las distintas materias, deberían ser claramente perceptibles las reacciones masivas del aniquilamiento mutuo resultante del encuentro. Así pues, los astrónomos observan especulativamente las galaxias, tratar de encontrar alguna actividad inusual que delate interacciones materia-antimateria.
…, ¿Hay masas de antimateria en el Universo? ¿Galaxias de antimateria?
Bueno, sabemos que no son las galaxias las que se alejan, sino que es el espacio el que se expande. Lo que no sabemos es encontrar antimateria en el espacio interestelar y, si la hay y está presente… ¡Aún no la hemos podido localizar! Algunos dicen que hay galaxias de antimateria y, yo digo que tengo un pariente en la galaxia Astrinia del cúmulo Ultramón a diez mil millones de años-luz de nuestra región.
No parece que dichas observaciones, al menos hasta el , hayan sido un éxito.
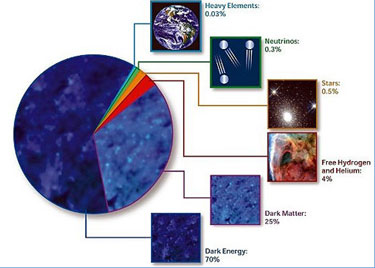
Según estimaciones recientes, resumidas en gráfico de la NASA, alrededor del 70% del contenido energético del Universo consiste en energía oscura, cuya presencia se infiere en su efecto sobre la expansión del Universo pero sobre cuya naturaleza última no se sabe casi nada.
¿Es posible que el Universo este formado casi enteramente por materia, con muy poca o ninguna antimateria? Y si es así, ¿por qué? dado que la materia y la antimateria son equivalentes en todos los aspectos, excepto en su oposición electromagnética, cualquier fuerza que crease una originaria la otra, y el Universo debería estar compuesta de iguales cantidades de la una y de la otra.

Este es el dilema. La teoría nos dice que debería haber allí antimateria, pero las observaciones lo niegan, no lo respaldan. ¿Es la observación la que falla? ¿Y qué ocurre con los núcleos de las galaxias activas, e incluso más aún, con los causares? ¿Deberían ser estos fenómenos energéticos el resultado de una aniquilación materia-antimateria? ¡No creo! Ni siquiera ese aniquilamiento parece ser suficiente, y los astrónomos prefieren aceptar la noción de colapso gravitatorio y fenómenos de agujeros negros como el único mecanismo conocido para producir la energía requerida.
Estábamos hablando de mecánica cuántica y me pasé, sin que me diera , al ámbirto de la antimateria y el espacio del macro universo de las galaxias. Sin embargo, y aunque parezcan temas dispares, lo cierto es que, a medida que profundizamos en estas cuestiones, todas nos llevan, de una u otra manera, a relacionar el “mundo de lo muy pequeño” con el “mundo” de lo muy grande que, al fín y al cabo, está hecho de lo que existe en el primero, es decir, partículas infinitesimales de materia y… ¡de antimateria! para que todo quede compensado.
emilio silvera
Jun
22
¡El Núcleo Atómico! Y mucho más
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (0)
Comments (0)
El propio Rutherford empezó a vislumbrar la respuesta a la pregunta que arriba hacemos. 1.906 y 1.908 (hace más de un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos.
En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.

Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
En 1.908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
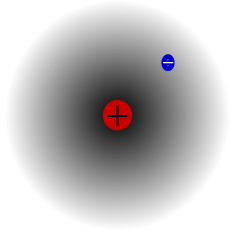
Átomo de hidrógeno, núcleo y electrón.
entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por medio un electrón que participe, actúa un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.

Hay un tercer elemento, el litio, cuyo átomo tres electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de carga positiva en el núcleo atómico deben ser numéricamente idénticas a los electrones que contiene por norma, pues el átomo suele ser un cuerpo neutro, y esta igualdad de lo positivo con lo negativo es el equilibrio. De hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el de electrones atómicos dentro de la formación iónica, en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.

Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía el núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó idea general. Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.
Pero entre tanto se habían presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal, y ello dio lugar a una interesante historia.

Los tres isótopos naturales del carbono: carbono-12 (6 protones y 6 neutrones), carbono-13 (6 protones y 7 neutrones) y carbono-14 (6 protones y 8 neutrones). En los tres casos es carbono, tiene el aspecto de carbono y se comporta químicamente como carbono, por tener seis protones (y parte de nuestro organismo, por ejemplo). Sin embargo, sus propiedades físicas varían. Por ejemplo, mientras que el carbono-12 y el carbono-13 son estables, el carbono-14 es inestable y radioactivo: emite radiación beta, uno de sus neutrones “extras” se transforma así en un protón y el núcleo se convierte en nitrógeno-14 (que tiene 7 protones y 7 neutrones), con el aspecto y las propiedades del nitrógeno (por tener 7 protones). Dado que la mitad de la masa del carbono-14 pasa a ser nitrógeno-14 cada 5.730 años aproximadamente (más o menos lo que llevamos de civilización humana), la presencia de este isótopo natural resulta especialmente útil la datación precisa de objetos históricos.
Isótopos; construcción de bloques uniformes
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios ( lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.

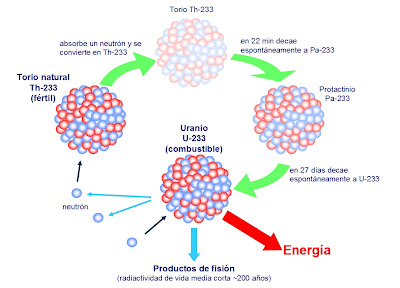
El Uranio 235 que es el único que de manera natural es apto para la fisión nuclear, es escaso, sólo el 7 por 1.000 es uranio 235, el resto, es uranio 238 que, no es combustible nuclear y, la madera mojada, no arde. Sin embargo, si se bombardea con neutrones lentos del uranio 235, resulta que se convierte en Plutonio 239 que sí, es combustible nuclear válido. ¡Qué no idearemos para conseguir los objetivos!
El Uranio es muy radiactivo y si está enriquecido… ¡Ya sabemos las consecuencias!
principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra , Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.
Por entonces, Rutherford, a su vez, separó del torio un torio X muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.
El Radón, uno de los llamados gases nobles, es incoloro, inodoro e insípido, además de – nuestro mal- radioactivo. Suele presentarse según el tipo de suelos de determinadas zonas y con la descomposición de uranio, concentrándose en la superficie y siendo “arrastrado” en y por el aire que respiramos, y es en grandes cantidades es un gas perjudicial para la salud… y que anticipa terremotos.

Varios químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).
En total se identificaron unos cuarenta miembros de esas series, y uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.
bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados. Entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907 los químicos americanos Herbert Newby McCoy y W. H. Ross descubrieron que el radiotorio (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio D, el mismo que el plomo, tanto que a veces era llamado radioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.
En 1.913, Soddy esclareció idea y le dio más amplitud. Demostró que cuando un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.
Soddy dio el de isótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
El modelo protón–electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula alfa de un núcleo, se reducía en dos unidades la carga positiva de dicho núcleo, exactamente lo que necesitaba para dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!
¿Cómo se explica que cuando el torio se descompone en radiotorio después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en proceso el átomo de torio pierde una partícula alfa, luego una partícula beta, y más tarde una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque en cierto modo, esto no afecta al resultado).
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía el atómico 90, es decir, el mismo de antes.
Así pues, el radiotorio, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de un átomo están sujetas al número de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o número másico. Así, el torio corriente se denomina torio 232, y el radiotorio, torio 228. Los isótopos radiactivos del plomo se distinguen por estas denominaciones: plomo 210 (radio D), plomo 214 (radio B), plomo 212 (torio B) y plomo 211 (actinio B).

Se descubrió que la noción de isótopo podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206, la del torio en plomo 208 y la del actinio en plomo 207. cada uno de estos era un isótopo estable y corriente del plomo, pero los tres plomos diferían por su peso atómico.
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.

Sabiendo todo lo anteriormente explicado, hemos llegado a comprender cómo de la Astronomía que estudia las características físicas y químicas de los cuerpos celestes, la astrofísica es la parte más importante de la astronomía en la actualidad debido a que, al avanzar la física moderna: Efecto Doppler-Fizeau, el efecto Zeeman, las teorías cuánticas y las reacciones termonucleares aplicadas al estudio de los cuerpos celestes han permitido que el campo magnético solar, el estudio de las radiaciones estelares y sus procesos de fusión nuclear, y determinar la velocidad radial de las estrellas, etc . radiación electromagnética de los cuerpos celestes permite realizar análisis de los espectros que nos dicen de qué están hechas las estrellas y los demás cuerpos del espacio interestelar y, de esa manera, hemos ido conociendo la materia y sus secretos que, cada vez, van siendo menos.
emilio silvera
Jun
20
Sí, el Universo tiene memoria
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El saber: ¡Ese viaje interminable! ~
Clasificado en El saber: ¡Ese viaje interminable! ~
 Comments (1)
Comments (1)
Podríamos hablar del de la luz, desde que surgió a partir del Big Bang (si fue ese el comienzo de todo), y suponiendo que ya tengamos los aparatos tecnológicos precisos para poder leer, los mensajes que la misma luz lleva escritos de lo que allí, en aquellos comienzos, pudo pasar. La Luz que es emitida por los cuerpos celestes y que nos trae su memoria que están recogidas en el interior de las partículas elementales que son las que dan a todos los objetos grandes constituídas en moléculas. Es realmente un canto a la Luz, a su compleja estructura que no hemos llegado a comprender. La luz nos trae mensajes y recuerdos de los orígines en remanentes de estrellas supermasivas que dieron lugar a la creación de otras estrellas y sistemas planetarios y, ¿quién sabe? si también formas de vida.
Lo cierto es que, el Universo, como un todo, nos presenta y manifiesta correlacions bien afinadas que desafían cualquier explicación de sentido común y, luego, no es que nuestro sentido común no sea el más común de los sentidos, se trata simplemente de que, no llega a captar la esencia verdadera de lo que el Universo nos quiere transmitir.

Decir Universo es decirlo todo,
Inmensas galaxias cuajada de soles,
Donde orbitan los mundos,
Donde, de la vida, surgen los crisoles.
Todo es fuerza y energía,
Inmersas en un espacio-tiempo,
Transiciones de fase que guían,
Grandes acontecimientos.
La Memoria del Universo,
La Huella que deja el Tiempo,
Quedan gravados los sucesos,
Que descubre el conocimiento.

Sí, el Universo es mucho más que simples estrellas o las galaxias que las acogen, el Universo es el Tiempo y el Espacio, son Universo las interacciones fundamentales que hace que nuestros mundos sean tal como los conocemos y, gracias a la variedad, la diversidad, las fuerzas y las constantes que en él están presentes, podemos decir que, los muchos mundos que son, algún día lejano en el futuro, nos darán la oportunidad de conocernos, nosotros los huamanos de la Tierra y otros seres de más allá de nuestras fronteras que ahora, por imposibilidades físicas y tecnológicas, no podemos hacer una realidad.

En las rocas más antiguas de la Tierra, fósiles con miles de millones de años nos contemplan
El primer signo de vida en nuestro planeta data de 3,850 millones de años. Son simples formas fósiles encontradas en Groenlandia Sí, también eso de arriba es Universo. Cuando se creó la vida, surgieron unos seres que, evolucionados, llegaron a ser conscientes de su ser y pudieron desarrollar ideas y pensamientos y…también sentimientos que nos llevan de manera directa, mediante fuerzas irresistibles de la Naturaleza, a crear Entropía Negativa compensar la que acompaña al Tiempo y que tanto daño hace en las cosas vivas o inertes.

Hemos realizado muchos estudios y llegado a muchas conclusiones que, finalmente, resultaron prematuras. Las mediciones actuales, por ejemplo, del fondo cósmico nos indican que, aun cuando toda la materia del Universo se hubiera originado en el (supuesto) big bang, sin embargo, el espacio-tiempo es plano: el universo se equilibraría con precisión entre la expansión y la contracción. Y, sin embargo, ¡las galaxias se están expandiéndo! Quizá después de todo, existe una constante cosmológica o fuerza similar no descubierta que es el que mantiene el cosmos en de expansión.

Los cosmólogos dudan del vacío cuántico y no creen que sea el origen de las energías extrañas representadas representadas por estas constantes. El espacio está lleno de partículas virtuales, en constante variación. La energía de las partículas virtuales concuerdan con los efectos que le atribuyen, incluso cuando tienen una existencia tan breve que no se medir. Se cree que esta energía, la “constante cosmológica positiva” es la responsable de la expansión acelerada de las galaxias. Esta suposición que no es nueva, es una más de las muchas que circulan por el mundo científico de la cosmología en el que, los “expertos” cosmólogos, andan locos por averiguar de qué se trata todo esto que no llegan a comprender.

El problema del horizonte. La coherencia que presentan las realciones núméricas se ve reforzada por la evidencia de la observación. Ésta última da lugar al llamado “problema del horizonte” : el problema de la uniformidad en la gran escala del Cosmos en todos los puntos del horizonte visto desde la Tierra. Este problema empezó a destacarse tanto en relación a la radiación del fondo del Universo, en relación a la evolución de sus galaxias.
“Nuestro universo parece ser completamente uniforme. Si miramos a través del espacio un extremo del universo visible hacia el otro, se verá que la radiación de fondo de microondas que llena el cosmos presenta la misma temperatura en todas partes.”

“Esto podría no parecer muy sorprendente, que se considera que los dos bordes están separados por casi 28 mil millones de años luz y que nuestro universo tiene apenas algo menos de 14 mil millones de años de edad.”
“Nada más rápido que la de la luz, de modo que no hay en que la radiación pueda haber viajado entre los dos horizontes para igualar los puntos calientes y los fríos creados en el Big Bang y dejar así el equilibrio termal que hoy vemos.”
Está claro que el problema del Horizonte se les ha ido de las manos a los Cosmólogos que no lo saben explicar y, ello, tratan de hilvanar extrañas historias y exóticas teorías que, de ninguna manera nos satisfacen.
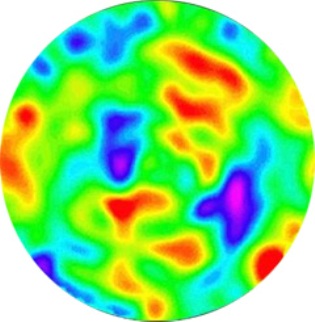
Imagen: Las fluctuaciones de densidad de 1/100 000 de Kelvin son tratados de la radiación de microondas fósiles 2,73 K. Ellos muestran que alrededor de 380 000 años después del Big Bang, había áreas heterogéneas en el mundo, con un tamaño de entre 100 y 1 000 Mpc.
Como suele pasar siempre que mentes pequeñas quieren expñlicar cosas muy grandes, que no llegan a comprender, se limitan a inventar teorías y hacen conjeturas que, más o menos puedan estar acordes con la realidad que debería ser. El desarrollo de la cosmología física está lleno de enigmas que no podemos explicar y de anomalías que las teorías actuales tratan de desarrollar de la manera más coherente posible y, algunas se acercan y otras, quedan lejos de ser, ni siquiera admisibles por fantásticas e increíbles.
Lo dicho tántas veces…¡Nuestra ignorancia!
emilio silvera
Jun
20
¡Alejandría! La Cultura y el Saber
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El saber del mundo ~
Clasificado en El saber del mundo ~
 Comments (0)
Comments (0)
![[I] Las 7 Maravillas del Mundo Antiguo](http://lh4.ggpht.com/_0_XWhqXM2VQ/S5KzPr5Ph7I/AAAAAAAAJs8/tYOgGOOTr7w/1692387141_5f1bab9da9_thumb4.jpg?imgmax=800)
La construcción del Faro de Alejandría consistía en una amplia base cuadrada y una torre octogonal de unos 100 metros de altura. En la parte superior ardía leña y resina; ésa luz servía de aviso y señal a los navegantes. Para los marineros, significó un guía seguro para sus retornos al gran puerto. Para los arquitectos, significó aún más; era el edificio más alto sobre la tierra y para los científicos era lo misterioso; poseía un espejo que los fascinó. El espejo daba un reflejo que podría ser visto a más de 50 Km., fuera de la costa. Su ubicación se sitúa sobre la antigua Isla de Faros, un promontorio dentro de la ciudad de Alejandría.

La ciudad de Alejandría, en Egipto, una ciudad situada entre Oriente y Occidente, que fue durante varios siglos el centro del saber, “un centro de cálculo”, “un lugar paradigmático”. Fundada por Alejandro Magno en 331 a.C., en por su deseo de acercar Egipto al mundo griego y en parte porque quería un puerto que no se viera afectado por las inundaciones del Nilo.
Alejandría fue pensada desde el principio como una “megalópolis”, construida en de chlamys, una capa militar Macedonia, y provista de murallas que se extenderían “sin cesar” en la distancia, con las calles tan amplias como nunca se había visto, basada en el diseño aristotélico de la ciudad ideal (una cuadrícula dispuesta de tal manera que se beneficiara de las brisas marinas, pero proporcionara refugio frente al viento).
Un tercio de la ciudad era “territorio real”, y ésta constituía un centro de comercio convenientemente situado en el extremo oriental del Mediterráneo, cerca del lugar en el que el Nilo y el mar Rojo conforman un cruce de caminos internacional, y donde muchas caravanas procedentes del interior de África y de Asia convergían en la costa.
Disponía de dos puertos, uno de los cuales ostentaba el famoso faro de casi cuarenta y cinco metro de alto (otros historiadores dicen que cien), una de las maravillas del mundo antiguo, que podía ser visto una distancia de más de cincuenta kilómetros.

Tras la muerte de Alejandro, sus generales se pelearon entre sí, lo que finalizó con una división del imperio en la que Selenco se hizo con el control de la parte septentrional, incluidos Israel y Siria, mientras que los territorios egipcios quedaron bajo el control de Ptolomeo I, al menos desde el año 306 a.C.
Con todo, Alejandría era principalmente famosa como centro de conocimiento. Según la tradición, el mismo Alejandro, cuando hubo decidido cuál era el lugar ideal su nueva ciudad, ordenó también la construcción en ella de una gran Biblioteca dedicada a las musas.

La idea no era nueva: en Babilonia se habían reunido diversas bibliotecas y otras habían surgido en diversos lugares del Mediterráneo, en particular en Pérgamo y Efeso. No obstante, el principio la ambición era mayor en Alejandría que en cualquier otro lugar y, en palabras de un estudioso, lo que se organizó allí fue una verdadera “fuente del conocimiento”. Ya en 283 a.C. había un sínodo, una comunidad de entre treinta y cincuenta hombres instruidos (sólo hombres), vinculado a la biblioteca y dotado de especiales privilegios: los estudiosos estaban exentos del pago de impuestos y podían abastecerse y hospedarse gratis en el sector real de la ciudad.

La biblioteca estaba dirigida por un erudito-bibliotecario, nombrado por el rey y quien además ocupaba el cargo de tutor real. Esta biblioteca tenía varias alas, con filas de anaqueles, o thaike, dispuestos a lo largo de paseos cubiertos y provistos de nichos, en los que se guardaban las distintas categorías del saber. Había y un jardín botánico.
El primer bibliotecario fue Demetrio y para la época del poeta Calímaco, uno de sus sucesores más famosos, en el siglo III a. de C., la biblioteca poseía más de 400.000 rollos múltiples y noventa mil rollos únicos. Posteriormente, el Serapeo, la biblioteca hija de la de Alejandría, alojada en el templo de Serapis, un culto greco-egipcio, acaso basado en el de Hades, el dios griego de los muertos, llegó a reunir otros 40.000 rollos.
Calímaco creó el primer catálogo temático del mundo, el Pinakes, uno de cuyos efectos fue que para el siglo IV d.C., hasta cien estudiosos acudían a la vez a la biblioteca para consultar sus libros y discutir los textos unos con otros. distinguida comunidad existió durante unos setecientos años. Los estudiosos escribían sobre papiro, material sobre el que Alejandría mantuvo un monopolio durante cierto tiempo, y luego sobre pergamino, cuando el rey dejó de exportar papiro en un intento de impedir la construcción de bibliotecas rivales en otros lugares, en especial en Pérgamo.

Los libros de pergamino y papiro se escribían en rollos (su longitud era más o menos equivalentes a la de uno de nuestros capítulos) y se almacenaban en fundas de cuero o lino y se colocaban en estantes. la época de los romanos, no todos los libros eran ya rollos: se habían introducido los códices que se almacenaban en cajas de madera.
La biblioteca también contaba con muchos charakitai, “amanuenses” se los denominaba, y que eran de hecho traductores.
A los reyes de Alejandría, los Ptolomeos, les encantaba adquirir copias de todos los libros que aún no poseían, en un esfuerzo por reunir toda la sabiduría de Grecia, Babilonia, la India y demás lugares. En particular, Ptolomeo III Evergetes encargó a agentes que registraran todo el Mediterráneo en busca de textos y él mismo escribió a todos los soberanos del mundo conocido pidiéndoles que le prestaran sus libros para copiarlos.
Cuando le fueron prestadas las obras de Eurípides, Esquilo y Sófocles, conservó los originales y devolvió las copias que habían hecho, renunciando a la fianza que había pagado. De igual , todas las embarcaciones que pasaban por Alejandría estaban obligadas a depositar todos sus libros (los que transportaran) en la biblioteca, donde se los copiaba y catalogaba como “de las naves”. En su mayoría, lo que se devolvía a las naves eran las copias de los libros confiscados.

Una de aquella biblioteca de la antigüedad
Así, la riqueza de saber y cultura que acumuló aquella biblioteca del pasado fue incalculable e hizo que desempeñara un papel primordial en el mundo civilizado de la antigüedad. Entre los famosos estudiosos que se hicieron en Alejandría se encuentran Euclídes, quien pudo haber escrito sus Elementos durante el reinado de Ptolomeo I (323-285 a.C.), Aristarco, que propuso una descripción heliocéntrica del sistema planetario, y Apolunio de Perga, “el gran geómetra”, que escribió su influyente libro sobre las secciones cósmicas en la ciudad. Apolunio de Rodas fue el autor de la epopeya El de los argonautas (c. 270 a.C.) y quien presento a Arquímedes de Siracusa, que durante un tiempo se dedico a estudiar las crecidas del Nilo e inventó el tornillo que lo haría famoso. Arquímedes también inició la hidrostática y esbozó su método para calcular el área y el volumen que, mil ochocientos años después, conformaría las bases del cálculo.
Un bibliotecario posterior, Eratóstenes (276-196 a.C.), fue geógrafo y matemático. Gran amigo de Arquímedes, creía que todos los océanos de la Tierra estaban conectados entre sí, que algún día sería posible circunnavegar África y que podría llegarse a la India “navegando en dirección oeste España”.

Fue Eratóstenes quien calculó la duración correcta del año, quien propuso la idea de que la Tierra es redonda y quien calculó su diámetro con un error de 80 km.
Eratóstenes también dio origen a la ciencia de la cronología al establecer con mucho cuidado las fechas de la caída de Troya (1.184 a.C.), la primera olimpiada (776 a.C.) y el estallido de la guerra de peloponeso (432 a.C.). Asimismo, ideó el calendario que finalmente establecería Julio Cesar y diseño un método identificar los números primos.
los estudiosos se le conocía como “Beta” (Platón era “Alfa”).

Los Elementos de Euclides es un texto reconocido por lo general como el más influyente de todos los tiempos. Escrito hacia el año 300 a. C., de él se han hecho muchísimas copias de ediciones que, lo convierta en el libro más reeditado en el mundo después de la Biblia (sus contenidos, más de 2.000 años después, aún se enseñan en las escuelas de secundarias).
Es posible que Euclides (ev significa “bueno” y kleis significa “llave”) estudiara en la Academia de Platón, incluso con el gran maestro en persona (nació en Atenas hacia el año 330 a.C.); aunque no produjo ninguna nueva idea en sí, sus Elementos (Stoichia) se consideran una historia completa de la matemática griega hasta ese .
El libro comienza con una serie de definiciones, como la del punto (“lo que no tiene ”) o la línea (“una longitud sin amplitud”), describe diversos ángulos y planos, sigue después con cinco postulados (como el de que “puede trazarse una línea de un punto cualquiera a otro punto cualquiera”) y cinco axiomas, como el de que” todas las cosas iguales a la misma cosa son iguales entre sí”. Los trece libros, o capítulos, que siguen exploran la geometría del plano, la geometría de los sólidos, la teoría de los números, las proporciones y su famoso método de “agotamiento”. En este Euclides muestra cómo “agotar” el área de un círculo inscribiendo polígonos en él.

Dadme una palanca y moveré el mundo

Los famosos espejos de Arquímedes quemaban las velas de las embarcaciones enemigas.

También es digno de mención aquí un personaje singular como Arquímedes de Siracusa (287-219 a.C.), el más versátil de los matemáticos helénicos. Al parecer estudió en Alejandría durante un tiempo, con discípulos de Euclides, y aunque vivió principalmente en Siracusa, donde murió, estuvo en constante con los investigadores de esta ciudad.
Durante la segunda guerra púnica, Siracusa fue arrastrada por el conflicto entre Roma y Cartago y, unida a este último bando, fue sitiada por los romanos entre 214 y 212 a.C. Durante esta guerra, nos dice Plutarco en su vida del general romano Marcelo, Arquímedes inventó un gran de ingeniosas armas para defenderse del enemigo, incluidas catapultas y espejos capaces de prender fuego a las embarcaciones romanas. Pese a todo, sus esfuerzos resultaron inútiles y la ciudad cayó. Pese a que Marcelo había ordenado que respetaran la vida de Arquímedes, un soldado romano le mató con su espada mientras dibujaba una figura geométrica en la arena.
Arquímedes fue un innovador con sus ideas de extraordinario valor sobre las palancas, en su obra sobre el equilibrio de los planos, y sobre hidrostática, en sobre los cuerpos flotantes. En este último encontramos su famosa idea de que “cualquier sólido menos pesado que un fluido se hundirá, al ser colocado en él, el punto en el que el peso del fluído desplazado sea igual al peso del sólido”.
También exploró los números grandes, una preocupación que siglos después conduciría a la invención de los logaritmos, y consiguió el cálculo más acertado de p hasta la .

Mapa mundi de Claudio Ptolomeo
El último de los grandes matemáticos helénicos de Alejandría fue Claudio Ptolomeo, activo de 127 d.C.a 151 d.C. Su gran obra denominada inicialmente como Sintaxis matemática, compuesta por trece libros o capítulos, terminó conociéndose como Megiste, “la más grande”. Posteriormente, en el mundo musulmán, surgió la costumbre de llamar a libro por su equivalente árabe: Almagesto
Así es conocido entonces. Es fundamentalmente una obra de trigonometría, la rama de las matemáticas referente a los triángulos que estudia las relaciones entre sus ángulos y las longitudes de sus lados y cómo todo ello está relacionada con los círculos que los abarcan. A su vez, estos están relacionados con las órbitas de los cuerpos celestes y los ángulos de los planetas respecto de quien los observa desde la Tierra. Los libros siete y ocho de Almagesto ofrecen un catálogo de más de un millar de estrellas, dispuestas en cuarenta y ocho constelaciones.
mediados del siglo III a. C. Aristarco de Samos había propuesto que la Tierra giraba alrededor del Sol. La mayoría de los astrónomos, Ptolomeo incluido, rechazaban tal idea.

Aristarco de Samos
Quiero significar aquí que Alejandría fue por mucho tiempo el centro de las matemáticas griegas: Menéalo, Hezón, Diofanto, Pappo y Proclo de Alejandría contribuyeron todos a ampliar y desarrollar las ideas de Euclides, Arquímedes, Apolunio y Ptolomeo. No debemos olvidar que la gran era de la ciencia y la matemática griegas se prolongó desde el siglo VI a.C. hasta los comienzos del siglo VI d.c., más de un milenio de gran productividad. Ninguna otra civilización ha aportado tanto un periodo de tiempo tan largo. En aquel movimiento cultural también estuvo presente alguna mujer que todos tenemos en la mente.
Sin embargo, en Alejandría, las matemáticas o, al , los números tuvieron otro aspecto muy importante, y también muy diferente. Se trata de los denominados “misterios órficos” y su énfasis místico.

Según Marsilio Ficino, autor del siglo XV d.C., hay seis grandes teólogos de la antigüedad que forman una linea sucesoria. Zoroastro fue “el principal referente de los Magos”; el segundo era Hermes Trismegisto, el líder de los sacerdotes egipcios; Orfeo fue el sucesor de Trismegisto y a él le siguió Aglaofemo, que fue el encargado de a Pitágoras en los secretos, quien a su vez los confió a Platón. En Alejandría, Platón fue desarrollado culturalmente por Clemente y Filón, para crear lo que se conocería como neoplatonismo.
Tres ideas conforman los cimientos de los misterios órficos. Una es el poder místico de los números. La existencia de los números, su cualidad abstracta y su comportamiento, tan vinculado el del Universo, ejercieron una permanente fascinación sobre los antiguos, que veían en ellos la explicación de lo que percibían como armonía celestial.

La naturaleza abstracta de los números contribuyó a reforzar la idea de un alma abstracta, en la que estaba implícita la idea (trascendental en este contexto) de la salvación: la creencia de que habrá un futuro de éxtasis, al que es posible llegar a través de la trasmigración o reencarnación.
Por último, estaba el principio de emanación, esto es, que existe un bien eterno, una unidad o “monada”, de la que brotaba toda la creación. Como el , esta era considerada una entidad básicamente abstracta. El alma ocupada una posición intermedia entre la monada y el mundo material, entre la mente, abstracta en su totalidad, y los sentidos.
Según los órficos, la monada enviaba (“emanaba”) proyecciones de sí misma al mundo material y la tarea del alma era aprender usando los sentidos. De esta , a través de sucesivas reencarnaciones, el alma evolucionaba hasta el punto en el que ya no eran necesarias más reencarnaciones y se alcanzaba el momento de profunda iluminación que daba lugar a una forma conocida como gnosis, allí la mente esta fundida con lo que percibe. Es posible reconocer que esta idea, original de Zoroastro, subyace en muchas de las regiones principales del mundo, con distintas variantes o matices que, en esencia, viene a ser los mismos.
Pitágoras, en particular, creía que el estudio de los números y la armonía conducían a la gnosis. Para los pitagóricos, el número uno no era un número en realidad, sino la “esencia” del número, de la cual surge todo el sistema numérico. Su división en dos creaba un triángulo, una trinidad, la forma armónica más básica, idea de la que encontramos ecos en santísimas religiones.

Platón, en su versión más mítica, estaba convencido de que existía un “alma mundial”, también fundada en la armonía y el , y de la cual brotaba toda la creación. Pero añadió un importante refinamiento al considerar que la dialéctica, el examen crítico de las opiniones era el método para acceder a la gnosis.
La tradición sostiene que el cristianismo llegó a Alejandría a mediados del siglo I d.C., cuando Marcos el evangelista llegó a la ciudad predicar la nueva religión.
Las similitudes espirituales entre el platonismo y el cristianismo fueron advertidas de muy clara por Clemente de Alejandría (150-215 d.C.), pero fue Filón el indio quien primero desarrolló esta nueva fusión. En Alejandría habían existido escuelas pitagóricas y platónicas desde hacía un largo tiempo, y los judíos cultos conocían los paralelos entre las ideas judías y las tradiciones Geténicas, hasta el punto de que para muchos de ellos el orfismo no era otra cosa que “una emanación de la Torá de la que no había quedado constancia”.

El filósofo judio Filón de Alejandría
Filón era el típico alejandrino que “nunca confiaba en el sentido literal de las cosas y siempre estaba a la búsqueda de interpretaciones músticas y alegóricas”. Pensaba que podía “conectar” con Dios a través de ideas divinas, que las ideas eran “los pensamientos de Dios” porque ponían orden a la “materia informe”. Al igual que Platón, tenía una noción dualista de la Humanidad:
“De las almas puras que habitan el espacio etéreo, aquellas más cercanas a la tierra resultan atraídas por los seres sensibles y descienden a sus cuerpos”.
Las almas son el lado divino del hombre, se decía por aquel entonces.
Es interesante reparar en los hechos pasados y la evolución del pensamiento humano que, en distintos lugares del mundo y bajo distintas formas, todos iban en realidad a desembocar en el mismo mar del pensamiento. Siempre hemos querido saber, siempre hemos imaginado sobre lo que habrá más allá, en ese “universo” de lo inmaterial de la metafísica que nuestras mentes han ideado para explicar lo que no tiene explicación.

Más allá de nosotros… ¡están las estrellas!
La naturaleza humana y el orden universal, el primero unido a un alto concepto cuasi divino, el Alma, el segundo regido por la energía cósmica de las fuerzas naturales creadoras de la materia y, todo esto, desarrollado de una u otra manera por los grandes pensadores de todos los tiempos que hicieron posible la evolución del saber tomar posesión de profundos conocimiento que, en un futuro, nos podrán permitir alcanzar metas, que aún hoy, serían negadas por muchos.
Para mí, el mirar los hechos pasados y estudiar los logros alcanzados en todos los campos del saber, es una auténtica aventura que profundiza y lleva al conocimiento del ser humano que, según la historia, es capaz de lo mejor y de lo , sin embargo, nadie podrá negarle grandeza ni imaginación.
emilio silvera
Jun
20
¡Qué Historias!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Rumores del Saber ~
Clasificado en Rumores del Saber ~
 Comments (0)
Comments (0)

Lo cierto es que la Belleza, está por todas partes.No importa a donde miremos, allí estará. Simplemente se trata de que sepamos verla, en todo y en todos la belleza estará presente y, en cada Ser o en cada cosa, está presente ese punto mágico que la Naturaleza le dejó, toda vez que, de alguna manera, también esos seres y esas cosas, Naturaleza son. En relación a nosotros, alguna vez se me ocurre la pregunta:
—¿Qués es un ser humano?
Y, lo único que se me ocurre contrestar es…
—¡La perfección imperfecta!
Si nos damos una vueltecita por el pasado, podremos hacernos una idea de lo mucho que los habitantes del planeta de hoy, le debemos a aquellos que estuvieron presentes en épocas milenarias, cuando se construyeron las primeras ciudades, se escribieron los primeros signos, se inventó la rueda y el carro y se apacentó el ganado y se labraron los campos. También, se escribieron historias poéticas y se crearon mitos.

En alguna ocasión me he referido a los orígenes de la escritura (una cuestión muy polémica sobre uno de los pasos más importantes de la Humanidad), y, propiamente reconocida como tal, tiene más de un candidato, y en éste momento, son al menos tres. hablaros un poco de algunas hazañas del ser humano por este mundo, acudo a la obra de Peter Watson, Ideas, que hace un magistral recorrido por muchos de nuestros logros, y, aquí, en dos partes, os dejo una muestra.
Durante muchos años se dio como seguro que la escritura cuneiforme de Mesopotamia era la más antigua. Había, sin embargo, un inconveniente. El cuneiforme se compone de signos más o menos abstractos, y son muchos los que opinan que la primera escritura estaba relacionada con vínculos más fuertes e incuestionables con la pintura y los pictogramas, signos que son en dibujos de objetos y en parte símbolos.
Tablilla Sumeria
En ese punto, hay que referirse a la obra de la arqueóloga Denise Schamndt-Besserat que, a finales de la década de los sesenta, investigadora advirtió que por todo Oriente Próximo se habían encontrado miles de “objetos de arcilla bastante prosaicos” que la mayoría de los arqueólogos habían considerados insignificantes.
Ella, pensaba lo contrario: que dichos objetos podían haber conformado un antiguo sistema que los estudiosos habían pasado por alto. Visitó y estudió varias colecciones de estos “especimenes”, los llamaba, en Oriente Próximo, el norte de África, Europa y América.
En el curso de sus estudios, descubrió que aquellos especimenes tenían, algunas veces, formas geométricas (esferas, tetraedros, cilindros) mientras que otras tenían forma de animales, herramientas o embarcaciones. Además comprendió que se trataba de los primeros objetos de arcilla endurecidos por el fuego: fueran lo que fueran, su fabricación había requerido mucho trabajo y esfuerzo, y, luego, no eran prosaicos.


Tablilla de Ur
etapa silábica es conocida en sus comienzos por un grupo de textos de Ur correspondiente a la época de las dinastías I y II de Sumer (2800 a. C.). En esos textos encontramos el primer uso identificable de elementos fonéticos y de gramática, y en la medida en la que se puede identificar el uso de sílabas en la escritura cuneiforme, podemos conocer el lenguaje sumerio. La tablilla, procedente de Ur, c. 2900-2600 a. C., describe una entrega de cebada y comida a un templo

Tablilla de Shuruppak
Los primeros ejemplos de tablillas cuneiformes ya muestran un desarrollo progresivo en la de los signos y en la flexibilidad de su uso. Por ejemplo, la tablilla lateral procedente de Shuruppak, Fara, (2600 a. C.) registra cifras de trabajadores. De allí, según la literatura sumeria, procede el héroe del Diluvio, Ziusudra.
La escritura pictográfica proto-sumeria de las tablillas de Uruk y Jemdet Nasr, está escrita dentro de rectángulos o cuadrados dispuestos aleatoriamente. Los rectángulos están puestos en filas a ser leídos de derecha a izquierda y una fila se termina, comienza otra debajo.

Tablilla con el poema Enuma Elish
“…la partió en dos partes, una concha; la mitad la puso arriba y la denominó cielo. El construyó estancias para los grandes dioses. Fijando su apariencia astral como constelaciones. Designando las zonas, determinó el año.”

Finalmente, Dense tropezó con una descripción de una tablilla ahuecada encontrada en Nazi, un yacimiento del segundo milenio a. de C. al norte de Irak. La inscripción cuneiforme decía: “Cuentas que representan ganado pequeño: veinte ovejas, seis borregas, ocho carneros adultos…” y así sucesivamente.
Cuando se abrió la tablilla, se encontraron dentro cuarenta y nueve cuentas, exactamente el de animales escrito en la lista.
Para Schmandt-Besserat, aquello fue “como una piedra Rosetta”. Durante los siguientes quince años examinó más de diez especímenes y concluyó que estos constituían un sistema primitivo de y, en particular, uno que conduciría a la invención de la escritura.
Según el historiador H.W.F.Saggs, “ninguna invención ha sido más importante para el progreso humano que la escritura”. Por su , Petr Charvát la llamó “la invención de las invenciones”.

Por tanto tenemos aquí otra idea capital que poner junto a la agricultura como “la más grandiosa de todos los tiempos”. Pero, no podemos pararnos ahí. Los sumerios inventaron también el carro, un hecho básico la historia del progreso de la humanidad. La cuestión es que si hacemos una lista de los logros que este formidable pueblo realizó antes que cualquier otro, sería difícil saber cuando parar.
En 1946, el erudito estadounidense Samuel Noah Kramer empezó a dar a conocer sus de las tablillas de arcilla sumerias, en las que identificó no menos de veintisiete “primeros históricos” logros conseguidos, descubiertos o registrados por primera vez por los antiguos iraquíes. Entre ellos tenemos las primeras escuelas, el primer historiador, la primera farmacopea, los rimeros relojes, el primer arco arquitectónico, el primer código jurídico, la primera biblioteca, el primer calendario agrícola y el primer congreso bicameral. Los sumerios fueron los rimeros que utilizaron los jardines para proporcionar sombra y frescor, los primeros en recoger proverbios y fábulas y los primeros en tener literatura épica y canciones de amor.

Toda la historia de Sumeria está embebida en el misterio
La razón para tan extraordinaria explosión de creatividad no es difícil de encontrar: la civilización, lo que hoy reconocemos como tal, sólo apareció después de que el hombre antiguo hubiera empezado a vivir en ciudades. Las ciudades era el entorno más competitivo y experimental que cualquier otro que las hubiera precedido. La ciudad era la cuna de la cultura, el lugar en el que nació casi la totalidad de nuestras ideas más preciadas. Allí se podía mostrar a otros las cosas que éramos capaces de realizar en todos los ámbitos: , arte, etc.
En algún momento a finales del cuarto milenio a. de C., la gente empezó a vivir en grandes ciudades. El cambio transformó la experiencia humana, pues las nuevas condiciones de vida exigían que hombres y mujeres cooperaran de formas hasta entonces inéditas. Fue este estrecho , este nuevo estilo de cohabitación frente a frente, lo que explica la proliferación de nuevas ideas encaminadas a satisfacer necesidades, ocio, y en definitiva: mejor forma de vida.

Muestra de cerámica encontrada en la “Casa Incendiada” TT6 en Tell Arpachiyah, norte de Irak, periodo Halaf, alrededor del 4500 a. C. Tell Brak alguna vez había sido un importante pueblo en una importante ruta de comercio que conectaba a la Mesopotamia con el Mediterráneo. El enorme montículo que marcaba el lugar estaba cerca de Chagar Bazar.
De acuerdo con la investigación publicada a finales de 2.004, los primeros centros urbanos fueron Tell Brak y Tell Hamourak al norte de Mesopotamia, en la actual frontera Irak y Siria, que se remontaría al año 4.000 a. de C. Pero estos asentamientos eran relativamente pequeños (Hamourak tenía doce hectáreas) y las primeras ciudades propiamente dichas emergieron más al sur hacia 3.400 a. de C. Entre las ciudades de Mesopotamia se incluyen (el orden cronológico es aproximado) Eridu, Uruk, Ur, Umma, Lagash y Shuruppak.
Uruk, por ejemplo, tenía una población fija de unos cincuenta mil habitantes. El origen más obvio de éstas grandes ciudades hay que buscarlo en la seguridad. Sin embargo, hay otras grandes ciudades de la antigüedad -especialmente en países de África occidental como Malí- que nunca levantaron murallas. En el mismo Uruk (que significa área amurallada). Las murallas no se construyeron hasta mucho después de estar, en buena medida construida, aproximadamente el año 2.900 a. de C.
Las especiales dinásticas reinantes en Mesopotamia, donde la irrigación pudo mejorar de forma sustancial los cultivos y donde había suficiente agua disponible, hizo del lugar un paraíso y las ciudades crecieron en aquellos lugares donde relativamente cerca, tenían piedra, madera, minerales, metales y en definitiva, materias primas.

En aquellos tiempos y en aquellos lugares la Humanidad fue creando su verdadera historia de seres modernos que miraban las estrellas del cielo y se hacían preguntas, que observaban la Naturaleza y de ella aprendían y que, en fin, idearon mil y una maravillas que, muchos miles de años más tarde, nosotros, nos pudiéramos aprovechar de todas aquellas proezas de la mente humana.
En realidad, todavía no sabemos con certeza dónde surgió por primera vez el cero, y el concepto de nada, de vacío, y si llegaron los mayas de manera independiente. Algunos sitúan la aparición del cero en China. No obstante, nadie discute la influencia india, y todo aparece indicar que fueron ellos los primeros que emplearon a la vez los tres nuevos elementos en que se funda nuestro actual Sistema numérico:
- una base decimal,
- una notación posicionad y cifras para diez, y
- sólo diez, numerales. Y esto ya establecido en 876.
En algún se dio por hecho que el cero provenía originalmente de la letra griega omicrón, la inicial de la palabra ouden, que significa “vacío”.
emilio silvera
Los logros de estas ciudades y Ciudades-Estados fueron asombrosos y perduraron veintiséis siglos. Introdujeron un extraordinario número de las innovaciones que contribuyeron a crear el mundo que hoy conocemos.
















 Totales: 77.774.910
Totales: 77.774.910 Conectados: 21
Conectados: 21
























