Oct
7
Cosas que debemos saber
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (2)
Comments (2)
Refiriéndonos al silicio, que para nosotros no es el más importante, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.
Estructura molecular del dióxido de Silicio
Superficie de Silicio orgánico
¿Posible vida basada en el Silicio? Difícil, no imposible
El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Fuerzas de van der Waals
“En los organismos se encuentran cuatro tipos diferentes de moléculas orgánicas en gran cantidad: carbohidratos, lípidos, proteínas y nucleótidos.
Todas estas moléculas contienen carbono, hidrógeno y oxígeno. Además, las proteínas contienen nitrógeno y azufre, y los nucleótidos, así como algunos lípidos, contienen nitrógeno y fósforo.”
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.
…ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse…
Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva).
polo químico
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Un gas es una sustancia formada por moléculas
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece desde el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).
Plasma el 4º estado de la materia
Si las temperaturas reinantes, como decíamos en páginas anteriores, es de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
En el Universo el Plasma está por todas partes
Para quien este interesado en este cuarto estado de la materia la materia, diremos que se manifiesta de muchas maneras en el Universo. En las estrellas…sobre todo
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.
Sal de cocina y sales químicas
El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina. Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición.
Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.

Salinas en Huelva que producen la Sal común que refinada y purificada vemos en la mesa y cocina
Ejemplo la sal común de mesa, cuya fórmula es NaCl (Cloruro de Sodio).
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
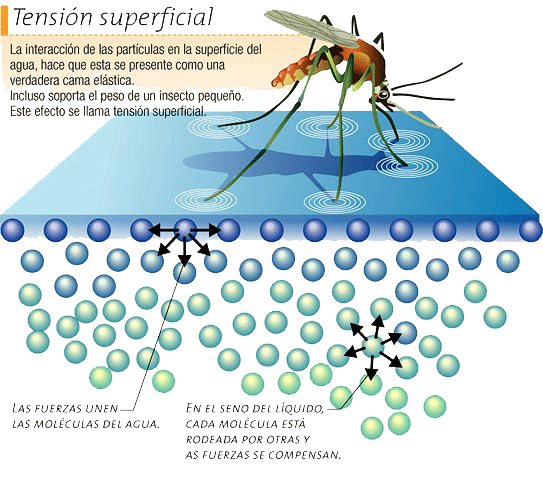
Esto es posible gracias a la fuerza de Van der Waals
emilio silvera
















 Totales: 77.897.325
Totales: 77.897.325 Conectados: 49
Conectados: 49























el 26 de agosto del 2011 a las 22:22
Un buen artículo divulgativo de Química a un nivel muy asequible ¡enhorabuena!
Como este año 2011 es el de la Química (y el de las mujeres científicas), por ser el centenario del Premio Nobel de Química de Marie Curie, me gustaría que sacases algún comentario alusivo.
Gracias de antemano.
el 7 de octubre del 2020 a las 9:27