Abr
16
Las moléculas portadoras de información
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Cosas curiosas ~
Clasificado en Cosas curiosas ~
 Comments (0)
Comments (0)
¡La Física! Cuando se asocia a otras disciplinas ha dado siempre un resultado espectacular y, en el caso de la Astronomía, cuando se juntó con la Física, surgió esa otra disciplina que llamamos Astrofísica. La Astrofísica es esa nueva rama de la Astronomía que estudia los procesos físicos y químicos en los que intervienen los fenómenos astronómicos. La Astrofísica se ocupa de la estructura y evolución estelar (incluyendo la generación y transporte de energía en las estrellas), las propiedades del medio interestelar y sus interacciones en sus sistemas estelares y la estructura y dinámica de los sistemas de estrellas (como cúmulos y galaxias) y sistemas de galaxias. Se sigue con la Cosmología que estudia la naturaleza, el origen y la evolución del universo. Existen varias teorías sobre el origen y evolución del universo (big bang, teoría del estado estacionario, etc.

Las estrellas, como todo en el Universo, no son inmutables y, con el paso del Tiempo, cambian para convertirse en objetos diferenters de los que, en un principio eran. Por el largo trayecto de sus vidas, transforman los materiales simples en materiales complejos sobre los que se producen procesos biológico-químicos que, en algunos casos, pueden llegar hasta la vida.

El Universo se expande, la Mente también I

Jefe Indio Seattle (1786 – 1866)
Antiguo es el mundo, pero parece que por fin empezamos a mirar los detalles y a buscar una forma de vida más ecológica, y al fin y al cabo, mejor para nosotros, ya que uno sin lo otro no sería posible. En este articulo hablamos del Jefe indio Seattle, un jefe indio que tuvo que negociar con el progreso que el hombre blanco implantó en las tierras de América, tierras en las que habían convivido en paz durante tantas generaciones y con el respeto hacia unos medios naturales que más tarde fueron explotados sin consideración, todo lo contrario a lo que indicaban las doctrinas de su pueblo.

Los organismos vivos somos sistemas extremadamente complejos, formados por un elevado número de elementos interrelacionados que deben mantener sus características a lo largo del tiempo, de una generación a otra. Esto supone que debe existir algún mecanismo para que cada elemento de los organismos se elabore de acuerdo a un “plan”, a un modelo de organización establecido, y que ese modelo pueda ser transmitido de una célula a sus descendientes. Esta necesidad de los seres vivos nos acerca a la noción de información genética.
La información, cualquier tipo de información, es un conjunto organizado de que pueden ser utilizados en algún proceso. En el caso de los seres vivos, los datos se refieren, fundamentalmente, a cómo son las moléculas (en particular las proteínas y el ARN) que la célula necesita producir y a cuándo deben ser elaboradas. La información necesita siempre una memoria, es decir, un sistema físico en el que pueda registrarse, almacenarse y que permita su lectura. En los seres vivos, que somos máquinas químicas, el soporte de la información es un tipo de molécula, concretamente un ácido nucleico. La información que almacenan los organismos recibe el nombre de información genética.
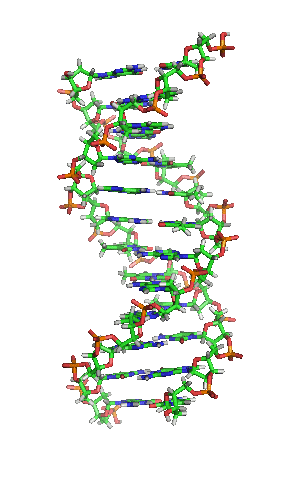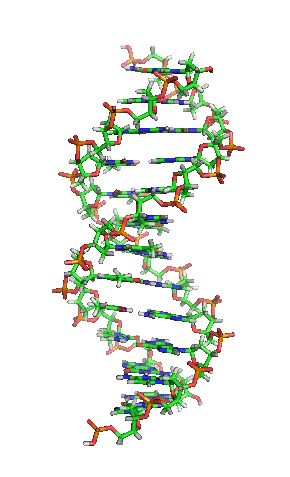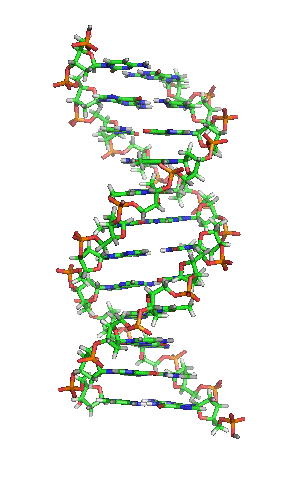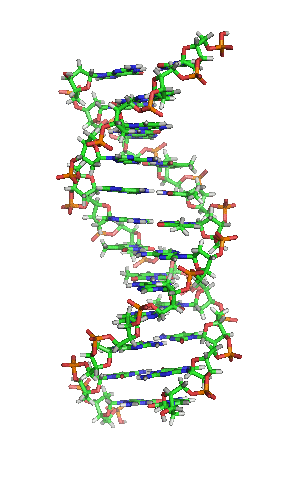
Representación esquemática de la molécula de ADN, la molécula portadora de la información genética. Las moléculas se forman por la Asociación de dos o más átomos, que se mantienen juntas por medio de enlaces químicos. Podríamos decir que algunas moléculasd de vida serían:



– Agua.
– Hidratos de carbono.
– Lípidos.
– Proteínas.
– Acidos Nucleicos.



Principios inmediatos o biomoléculas: cada una de las sustancias que componen la materia viva.
– Simples: O2
– inorgánicos: agua…
– Compuestos:
– orgánicos: glúcidos, lípidos,
proteínas, ac. nucleicos
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.

El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor. Refiriéndonos al silicio, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.
El cristal ideal no existe, en su natural, todos tienen inperfecciones y, sólo el elaborado, se podría decir que son cristales perfectos y, sin embargo, la mano del hombre lo que ha producido con tal intervención es perder una valiosa información inserta en ese cuerpo natural.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.



Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en figuras ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva en España).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.

Nubes moleculares en Orión
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece del gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).
El Plasma de las estrellas y otros cuerpos estelares forman el estado más común de la materia en nuestro Universo -al menos la que podemos observar-. El estado de la materia más común que conocemos es el plasma que es la forma que adopta en aquellos estados de altas energías como los que están presentes en las estrellas de las galaxias, los remanentes de supernovas, estrellas de neutrones y otros objetos celestes que adoptan ese estado material que emite una alta radiación.
Si las temperaturas reinantes, son de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Sustancias Compuestas y simples:
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.
El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina.


Es requerida por el organismo para mantener la volemia y procurar el adecuado equilibrio electrolítico. Además, conserva isotonicidad entre plasma e intersticio, así como también mantiene equilibrio con la célula. Implicada directa en el mantenimiento de la presión arterial media y en el equilibrio osmolar. Su disociación en sangre es parcial (sólo un 93 porciento).
Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.


Por esta zona de Huelva, conocida como Marismas del Odiel, llevaba con frecuencia a mis hijos pequeños que, jugando por aquellos parajes, se lo pasaban estupendamente, y, de camino, tenía la oportunidad de despertarles la curiosidad de cómo se producía la Sal en el medio natural dejando que se evapore el agua del Mar por los efectos del calor radiado por el Sol que dejaba, finalmente, la Sal al descubierto para ser refinada y vendida comercialmente.
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
emilio silvera
Mar
2
Las moléculas portadoras de información
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Cosas curiosas ~
Clasificado en Cosas curiosas ~
 Comments (0)
Comments (0)

Los organismos vivos somos sistemas extremadamente complejos, formados por un elevado de elementos interrelacionados que deben mantener sus características a lo largo del tiempo, de una generación a otra. Esto supone que debe existir algún mecanismo para que cada elemento de los organismos se elabore de acuerdo a un “plan”, a un modelo de organización establecido, y que ese modelo pueda ser transmitido de una célula a sus descendientes. Esta necesidad de los seres vivos nos acerca a la noción de información genética.
La información, cualquier tipo de información, es un conjunto organizado de que pueden ser utilizados en algún proceso. En el caso de los seres vivos, los datos se refieren, fundamentalmente, a cómo son las moléculas (en particular las proteínas y el ARN) que la célula necesita producir y a cuándo deben ser elaboradas. La información necesita siempre una memoria, es decir, un sistema físico en el que pueda registrarse, almacenarse y que permita su lectura. En los seres vivos, que somos máquinas químicas, el soporte de la información es un tipo de molécula, concretamente un ácido nucleico. La información que almacenan los organismos recibe el nombre de información genética.
Representación esquemática de la molécula de ADN, la molécula portadora de la información genética. Las moléculas se forman por la Asociación de dos o más átomos, que se mantienen juntas por medio de enlaces químicos. Podríamos decir que algunas moléculasd de vida serían:



– Agua.
– Hidratos de carbono.
– Lípidos.
– Proteínas.
– Acidos Nucleicos.



Principios inmediatos o biomoléculas: cada una de las sustancias que componen la materia viva.
– Simples: O2
– inorgánicos: agua…
– Compuestos:
– orgánicos: glúcidos, lípidos,
proteínas, ac. nucleicos
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.

El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor. Refiriéndonos al silicio, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.
El cristal ideal no existe, en su natural, todos tienen inperfecciones y, sólo el elaborado, se podría decir que son cristales perfectos y, sin embargo, la mano del hombre lo que ha producido con tal intervención es perder una valiosa información inserta en ese cuerpo natural.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.



Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva en España).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.

Nubes moleculares en Orión
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).

El Plasma de las estrellas y otros cuerpos estelares forman el estado más común de la materia en nuestro Universo -al menos la que podemos observar-. El esado de la materia más común que conocemos es el plasma que es la forma que adopta en aquellos estados de altas energías como los que están presentes en las estrellas de las galaxias, los remanentes de supernovas, estrellas de neutrones y otros objetos celestes que adoptan ese estado material que emite una alta radiación.
Si las temperaturas reinantes, son de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Sustancias Compuestas y simples:
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.
El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina.


Es requerida por el organismo para mantener la volemia y procurar el adecuado equilibrio electrolítico. Además, conserva isotonicidad entre plasma e intersticio, así como también mantiene equilibrio con la célula. Implicada directa en el mantenimiento de la presión arterial media y en el equilibrio osmolar. Su disociación en sangre es parcial (sólo un 93 porciento).
Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.


Por esta zona de Huelva, conocida como Marismas del Odiel, llevaba con frecuencia a mis hijos pequeños que, jugando por aquellos parajes, se lo pasaban estupendamente, y, de camino, tenía la oportunidad de despertarles la curiosidad de cómo se producía la Sal en el medio natural dejando que se evapore el agua del Mar por los efectos del calor radiado por el Sol que dejaba, finalmente, la Sal al descubierto para ser refinada y vendida comercialmente.
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
emilio silvera
Ene
26
Algo que sería de agradecer
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Cosas curiosas ~
Clasificado en Cosas curiosas ~
 Comments (2)
Comments (2)


sería bonito ver germinar las ideas que aquí siembro, y que surjan los comentarios
Es cierto que me repito una y otra vez pero, no parece que mis palabras caigan en buena tierra, la semilla no surge y, los comentarios (salvo excepciones), brillan por su ausencia. Aquí aparecen cada día algunos trabajos que han costado su tiempo elaborar y, en ocasiones, son trabajos originales que desgranan las ideas de este humilde divulgador. El poco eco encontrado en los visitantes del lugar, en ocasiones desalienta un poco y, se siente la soledad del que predica en el desierto.

El artista pinta sus cuadros para exhibirlos y que la gente los vea, que conozcan como ve él las cosas, cómo siente y, que de su obra hablen los demás, los que pasan a contemplarla. De esa manera, se crea una corriente “invisible” el pinto y el observador que califica su obra según la manera en que él la pueda ver y comprender y, de seguro, si tuviera al pintor delante, alguna pregunta o comentario le haría. ¿Por qué ustedes no aprovechais tal oportunidad?

También, el Poeta, vuelca sus sueños en la hoja en blanco, deja que de su pluma surjan los sueños y los sentimientos y, cuando estos salen el mundo, él agradecerá que los lectores comprendan esos sentimientos y, de ser posible, intercambien pareceres y situaciones vivídas que las haga más iguales, dado que, humanos, todos tendemos a tener, sentimientos parecidos en los distintos ámbitos del pensamiento.

¿Qué duda nos caber?
¿Acaso no es un libro el mejor compañero de viaje?
No molesta, te distrae y te enseña.
Si alguna vez viajas,
Recuerda reseña.

Nuestras mentes que están conectadas al Universo por esos hilos invisibles de la imaginación, y de las ideas que germinan a partir de profundos pensamientos, siempre ha tratado de entender lo que le enseñaba el mundo, la Naturaleza que …, llena de secretos nos va dejando saber, poco a poco, de sus muchos rincones oscuros que nosotros, aprendiendo, tratamos de ilumionar. De esa manera, aunque a una humilde escala, también tratamos aquí de que todos los visitantes puedean aprender y enseñarnos, y, para ello, amigo míos, necesitamos esa interrelación que se crea cuando se comentaais los trabajos aquí expuestos.
Si después de leer todo lo anteriormente escrito, el comentar no te molesta, aunque sea un sencillo pensamiento sobre algunos de los trabajos que has leido aquí… ¡Comenta tu parecer sobre el tema! El autor del lugar, el que te cuenta todas estas cosas que, unas veces te gustan y otras no, se asoma cada mañana (antes de poner nuevas páginas que puedas leer), para ver quien a expresado su parecer sobre alguno de los trabajos expuestos y poder, de esa manera, contestarle y entablar, esa entrañable relación virtual que, aunque sea en la distancia, siempre reconforta.

emilio silvera
Oct
12
Cosas que debemos saber
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Cosas curiosas ~
Clasificado en Cosas curiosas ~
 Comments (1)
Comments (1)
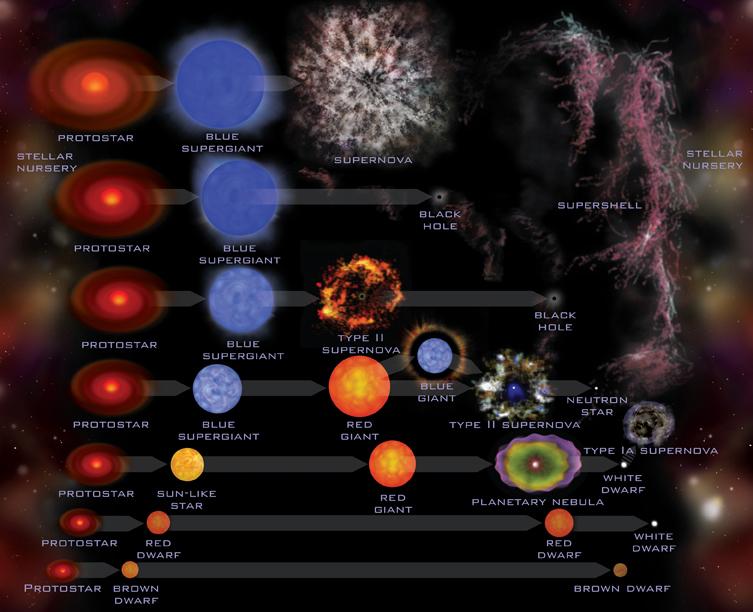
Nebulosa de Orión, M42 que es de relativa reciente creación. La nebulosa de Orión, también conocida como Messier 42, M42, o NGC 1976, es una nebulosa difusa situada al sur del Cinturón de Orión. Es una de las nebulosas más brillantes que existen, y puede ser observada a simple vista sobre el cielo nocturno. Está situada a 1.270±76 años-luz de la Tierra, y posee un diámetro aproximado de 24 años luz. Algunos documentos se refieren a ella como la Gran Nebulosa de Orión, y los textos más antiguos la denominan Ensis, palabra Latina que significa “espada”, nombre que también recibe la estrella Eta Orionis, que desde la Tierra se observa muy próxima a la nebulosa.

Esta es otra región de la misma Nenulosa de Orión
Pero hablemos un poco del Universo. Al principio todo era opacidad, las estrellas no llegaron al universo hasta después de pasados 200 millones de años desde el Big Bang, y, hasta que no se liberaron los fotones, no se hizo la luz.
Al principio, cuando el universo era simétrico, sólo existía una sola fuerza que unificaba a todas las que ahora conocemos, la gravedad, las fuerzas electromagnéticas y las nucleares débil y fuerte, todas emergían de aquel plasma opaco de alta energía que lo inundaba todo. Más tarde, cuando el universo comenzó a enfriarse, se hizo transparente y apareció la luz, las fuerzas se separaron en las cuatro conocidas, emergieron las primeras quarks para unirse y formar protones y neutrones, los primeros núcleos aparecieron para atraer a los electrones que formaron aquellos primeros átomos. Doscientos millones de años más tarde, se formaron las primeras estrellas y galaxias. Con el paso del tiempo, las estrellas sintetizaron los elementos pesados de nuestros cuerpos, fabricados en supernovas que estallaron, incluso antes de que se formase el Sol. Podemos decir, sin temor a equivocarnos, que una supernova anónima explotó hace miles de millones de años y sembró la nube de gas que dio lugar a nuestro sistema solar, poniendo allí los materiales complejos y necesarios para que algunos miles de millones de años más tarde, tras la evolución, apareciéramos nosotros.
Así podría ser el nacimiento de una nueva estrella
Las estrellas evolucionan desde que en su núcleo se comienza a fusionar hidrógeno en helio, de los elementos más ligeros a los más pesados. Avanza creando en el horno termonuclear, cada vez, metales y elementos más pesados. Cuando llega al hierro y explosiona en la forma explosiva de una supernova. Luego, cuando este material estelar es otra vez recogido en una nueva estrella rica en hidrógeno, al ser de segunda generación (como nuestro Sol), comienza de nuevo el proceso de fusión llevando consigo materiales complejos de aquella supernova.

Una región H II es una nube de gas y plasma brillante que puede alcanzar un tamaño de varios cientos deañosañuzy en la cual se forman estrellas masivas. Dichas estrellas emiten copiosas cantidades de ultravioleta extrema (con longitudes de onda inferiores a 912 Ångströms) que ionizan la nebulosa a su alrededor.
Puesto que el peso promedio de los protones en los productos de fisión, como el cesio y el kriptón, es menor que el peso promedio de los protones de uranio, el exceso de masa se ha transformado en energía mediante E = mc2. Esta es la fuente de energía que subyace en la bomba atómica.
Así pues, la curva de energía de enlace no sólo explica el nacimiento y muerte de las estrellas y la creación de elementos complejos que también hicieron posible que nosotros estemos ahora aquí y, muy posiblemente, será también el factor determinante para que, lejos de aquí, en otros sistemas solares a muchos años luz de distancia, puedan florecer otras especies inteligentes que, al igual que la especie humana, se pregunten por su origen y estudien los fenómenos de las fuerzas fundamentales del universo, los componentes de la materia y, como nosotros, se interesen por el destino que nos espera en el futuro.
Cuando alguien oye por vez primera la historia de la vida de las estrellas, generalmente (lo sé por experiencia), no dice nada, pero su rostro refleja escepticismo. ¿Cómo puede vivir una estrella 10.000 millones de años? Después de todo, nadie ha vivido tanto tiempo como para ser testigo de su evolución.
Sin embargo, tenemos los medios técnicos y científicos para saber la edad que tiene, por ejemplo, el Sol.
Sí, hemos podido llegar a conocer lo que ocurre en el Sol, y sabemos de sus procesos y de qué está compuesto. También sabemos el motivo por el que no se deja contraer bajo el peso de la fuerza de Gravedad que genera su propio peso y en qué se convertirá cuando llegue el final de su vida.
Nuestro Sol, la estrella alrededor de la que giran todos los planetas de nuestro Sistema Solar (hay que eliminar a Plutón de la lista, ya que en el último Congreso Internacional han decidido, después de más de 20 años, que no tiene categoría para ser un planeta), la estrella más cercana a la Tierra (150 millones de Km = UA), con un diámetro de 1.392.530 Km, tiene una edad de 4.500 millones de años.
Es tal su densidad, es tal su enormidad que, como se explicó en otro pasaje anterior de este mismo trabajo, cada segundo transforma por medio de fusión nuclear, 4.654.000 toneladas de hidrógeno en 4.650.000 toneladas de helio; las 4.000 toneladas restantes son lanzadas al espacio exterior en forma de luz y calor, de la que una parte nos llega a la Tierra y hace posible la vida. Se calcula que al Sol le queda material de fusión para otros 4.500 millones de años. Cuando transcurra dicho periodo de tiempo, se convertirá en una gigante roja, explotará como nova y se transformará finalmente en una estrella enana blanca. Para entonces, ya no podremos estar aquí.
Cuando mentalmente me sumerjo en las profundidades inmensas del universo que nos acoge, al ser consciente de su enormidad, veo con claridad meridiana lo insignificante que somos, en realidad, en relación al universo, Como una colonia de bacterias que habitan en una manzana, allí tienen su mundo, lo más importante para ellas, y no se paran a pensar que puede llegar un niño que, de un simple puntapié, las envíe al infierno.

Vista del Sol y de la Tierra en su órbita
Igualmente, nosotros nos creemos importantes dentro de nuestro cerrado y limitado mundo en el que, de momento, estamos confinados. Podemos decir que hemos dado los primeros pasos para dar el salto hacia otros mundos, pero aún nos queda un largo recorrido por delante.
Tendremos que dominar la energía del Sol, ser capaces de fabricar naves espaciales que sean impenetrables a las partículas que a cientos de miles de trillones circulan por el espacio a la velocidad de la luz, poder inventar una manera de imitar la gravedad terrestre dentro de las naves para poder hacer la vida diaria y cotidiana dentro de la nave sin estar flotando todo el tiempo y, desde luego, buscar un combustible que procure velocidades relativistas, cercanas a c, ya que de otra manera, el traslado por los mundos cercanos se haría interminable. Finalmente, y para escapar del sistema solar, habría que buscar la manera de romper la barrera de la velocidad de la luz.
emilio silvera
Ago
4
¿Convertir energía en materia? Será por soñar
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Cosas curiosas ~
Clasificado en Cosas curiosas ~
 Comments (0)
Comments (0)

En el pasado mes de mayo, algunos medios publicaron la noticia de que unos científicos habían logrado convertir Luz en Materia y, le ponían la coletilla de que… “El proceso recrea lo que ocurrió en los primeros 100 segundos del universo conocido”. La noticia decía:
“Científicos han logrado hacer materia a partir de luz pura, comprobando una teoría que fue descrita hace 80 años y en cierta forma llevando a cabo un principio universal de transformación. La idea de hacer materia con luz primero fue descrita por Gregory Breit y John Wheeler y en ese entonces creía que era imposible de realizar en el laboratorio, aunque evidentmente la famosa fórmula de Einsten E=mc2 indica que la materia y la energía son convertibles. Y ahora también, de manera empírica, la luz y la materia son intercambiables.
Para poder realizar esta asombrosa comprobación, físicos del Imperial College of London usaron lásers de alta energía y otros aparatos que existen en por lo menos en tres laboratorios en el mundo. Para materializar la luz, primero se disparan electrones a un bloque de oro, lo que produce un haz de fotones de alta energía. Luego se dispara un láser de alta energía a una cápsula llamada holhraum (“cuarto vacío” en alemán). Esto produce una luz tan brillante como la de las estrellas. En la etapa final, se dirige el primer haz de fotones al holhraum donde los flujos de fotones chocan: esto crea partículas subatómicas con masa. Suena como una especie de moderna receta de la piedra filosofal o un arma demiúrgica (aunque los científicos advierten que esto no permitirá materializar objetos de la nada y menos espadas de luz).”

“Sí, sería posible convertir energía en materia, hacerlo en grandes cantidades resulta poco práctico. Veamos por qué. Según la teoría de Einstein, tenemos que E = mc2, donde E representa la energía, medida en ergios, m representa la masa, medida en gramos, y c es la velocidad de la luz en centímetros por segundo. La luz se propaga en el vacío a una velocidad aproximada a los 30.000 millones (3×1010) de centímetros por segundo. La cantidad c2 representa el producto c×c, es decir: 3×1010 × 3×1010, ó 9×1020. Por tanto, c2 es igual a 900.000.000.000.000.000.000. Así pues, una masa de un gramo convertirse, en teoría, en 9×1020 ergios de energía.

Convertir la energía en materia requiere el poceso contrario al de converti la masa en energía, y, luego, se necesitaría una inmensa cantidad de energía para conseguir algo de masa. Fijémonos en que un fotón gamma, por ejemplo, aún siendo muy energético, sólo daría lugar a un electrón y un positrón (siendo la masa de ambos ridícula).
El ergio es una unida muy pequeña de energía que equivale a: “Unidad de o energía utilizado en el sistema c.g.s y actúa definida como trabajo realizado por una fuerza de 1 dina cuando actúa a lo largo de una distancia de 1 cm: 1 ergio = 10-7 julios”. La kilocaloría, de quizá mucho más conocido, es igual a unos 42.000 millones de ergios. Un gramo de materia convertido en energía daría 2’2×1010 (22 millones) de kilocalorías. Una persona sobrevivir cómodamente con 2.500 kilocalorías al día, obtenidas de los alimentos ingeridos. Con la energía que representa un solo gramo de materia tendríamos reservas para unos 24.110 años, que no es poco para la vida de un hombre.
O digámoslo de otro modo: si fuese posible convertir en energía eléctrica la energía representada por un solo gramo de materia, bastaría tener luciendo continuamente una bombilla de 100 vatios durante unos 28.200 años.

Claro que una cosa es convertir la masa en energía y otra muy distinta lo contrario, pero ¿ sería posible convertir energía en materia? Bueno, ya antes hemos dado la respuesta: Sí, pero a costa de un gasto ingente de energía que haría el poceso demasiado costoso y poco rentable. Fijémonos en estos ejemplos:
La energía que representa un gramo de materia equivale a la que se obtendría de quemar unos 32 millones de litros de gasolina. Nada tiene de extraño, por tanto, que las bombas nucleares, donde se convierten en energías cantidades apreciables de materia, desaten tanta destrucción.
La conversión opera en ambos sentidos. La materia se convertir en energía y la energía en materia. Esto último puede hacerse en cualquier momento en el laboratorio, donde continuamente convierten partículas energéticas (como fotones de rayos gamma) en 1 electrón y 1 positrón sin ninguna dificultad. Con ello se invierte el proceso, convirtiéndose la energía en materia.

De momento, no hemos podido conseguir gran cosa para fines pacíficos en lo que a las reacciones nucleares se refiere. Si acaso la energía de fisión de las Centrales nucleares que, en realidad, no es muy aconsejable, y, por otro lado, con fines armamentísticos con las bombas atómicas y de otro que utilizan la fusión.
Pero estamos hablando de una transformación de ínfimas cantidades de masa casi despreciable. ¿Pero podremos utilizar el mismo principio para conseguir cantidades mayores de materia a partir de energía?
Bueno, si un gramo de materia puede convertirse en una cantidad de energía igual a la que produce la combustión de 32 millones de litros de gasolina, entonces hará falta toda esa energía para fabricar un solo gramo de materia, lo que nos lleva al convencimiento de que no sería muy rentable el proceso”.
Fuente: Isaac Asimov
















 Totales: 84.495.105
Totales: 84.495.105 Conectados: 107
Conectados: 107