Ene
14
Sí, todo cambia. ¿Cual es la verdadera medida? ¡Llegar a comprender!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Tenemos que saber ~
Clasificado en Tenemos que saber ~
 Comments (0)
Comments (0)
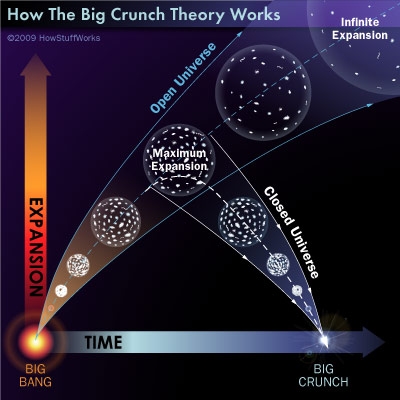
En otras ocasiones hemos presentado aquí trabajos que, entre los temas que fueron tratados, entraba el Universo estacionario y también la posibilidad de un final con la presencia del Big Crunch, lo cual, según todos los datos de la cosmología moderna, no será posible dado que, el Universo euclideo y la Densidad Crítica que se observa no sería suficiente para producir tal final. Por el contrario, la dinámica observada de expansión es cada vez más acelerada y, aunque algunos hablan de la “materia oscura”, en realidad no sabemos a qué se puede deber tal expansión pero, lo cierto es que no habrá colapso final y sí, en cambio, una expansión ilimitada que nos llevará hacia un “enfriamiento térmico” que llegará a alcanzar un máximo de entropía dS = dQ/T, así habrá una gran parte de la energía del Universo que no podrá producir trabajo. Sin embargo, es curioso que siendo eso lo que se deduce de los datos que tenemos, cuando miramos lo que predicen las nuevas teorías basadas en las cuerdas y la mecánica cuántica nos indica que tal escenario es poco creíble.
Todo parece indicar que nada podrá impedir que en las galaxias se sigan produciendo explosiones supernovas que formaran hermosas Nebulosas de las que nacerán nuevas estrellas, toda vez que las galaxias, quedarán aisladas y detendrán su expansiòn y tal hecho, no parece que pueda incidir en la mecánica galáctica de formación de nuevas estrellas. Así, las estrellas más masivas devolveran parte de la materia que las conforman al medio interestelar y la gravedad y la radiación se encargarán de que nuevos ciclos se sigan produciendo. Y, las estrellas menos masivas, como nuestro Sol y otras seguirán sus vidas durante miles de millones de años y, si tiene planetas en su entorno, ¿quién sabe si estando en la zona habitable no podrá hacer surgir alguna clase de vida? Claro que, el proceso de la dinámica del universo es llegar al frío absoluta de los -273 ºC y, en ese momento, las masas de las estrellas quedarían bloqueadas, los átomos presentes en las Nebulosas perderían su dinámica y nada, en nuestro Universo, tendría movimiento ni energía para crear trabajo, la Entropía sería la dueña y señora de todo y una última estrella habría nacido para quedar colapsada sin poder cumplir su misión de transmutar elementos.

Pero no pocas de todas estas conclusiones son conjeturas que se hacen conforme a los datos observados que llevan a esas consecuencias. En otros panoramas se podría contemplar como en el futuro, las estrellas escaparían lentamente de las galaxias y según algunos cálculos el 90% de la masa estelar de una galaxia habría huido al espacio en unos 10^19 años. El 10% restante habría sido engullido por agujeros negrossupermasivos centrales. El mismo mecanismo haría que los planetas escaparan de su soles y vagaran por el espacio como planetas errantes hasta perderse en el espacio profundo y, los que no lo hagan caeran hacia el centro de sus soles en unos 0^20 años.
Un último estudio ha indicado que el Universo es curvo, no plano como se creía y tal resultado, aunque tendrá que ser verificado, es importante para saber el final que realmente espera a nuestro Universo en ese futuro muy lejano en el que, no sabemos siquiera si nuestra especie andará aún por aquí.

Esa imagen de arriba no sería repetida y las galaxias, los cúmulos se disgregarían debido a interacciones gravitatorias en unos 10^23 años y, en un momento determinado el universo estaría formado por enanas negras, estrellas de neutrones y agujeros negros junto con planetas y pequeñas cantidades de gas y polvo, todo ello, sumergido en una radiación de fondo a 10^-13K. Hay modelos que predicen que los agujeros negros terminarán evaporándose mediante la emisión de la radiación de Hawking. Una vez evaporado el agujero negro, los demás objetos se convertirían en Hierro en unos 10^1500 años pero también, pasado mucho tiempo, se evaporaran y a partir de este momento el universo se compone de partículas aisladas (fotones, electrones, neutrinos, protones). La densidad tenderá a cero y las partículas no podrán interactuar. Entonces, como no se puede llegar al cero absoluto, el universo sufrirá fluctuaciones cuánticas y podría generar otro universo. ¿Qué locura!
Claro que toda esa teoría podría modificarse si la “energía oscura” -si finalmente existe- resultara ser negativa, con lo cual el fin se produciría antes. Tampoco se ha contado con la posible inestabilidad del protón. Todo esto está descrito según la física que hoy día se conoce, lo cual nos puede llevar a conclusiones erróneas. Como vereis, tenemos respuestas para todo y, aunque ninguna de ellas pueda coincidir con la realidad, lo cierto es que, el panorama de la cosmología está lleno de historias que, algunas podrán gustar más que otras pero todas, eso sí, están cargadas de una imaginación desbordante.

Como mi intelecto es más sencillo y no alcanza a ver en esas profundas lejanías, me quedo con lo más tangible y cercano como lo es el hecho cierto de que el Universo tiene que tener miles de millones de años para que haya podido tener tiempo suficiente para que los ladrillos de la vida sean manufacturados en las estrellas.
Las leyes de la gravitación nos dice que la edad del universo está directamente ligada a otras propiedades que manifiesta, como su densidad, su temperatura y el brillo del cielo. Puesto que el Universo debe expandirse durante miles de millones de años, debe tener una extensión visible de miles de millones de años-luz. Puesto que su temperatura y densidad disminuyen a medida que se expande, necesariamente se hace más frío y disperso. Ahora sabemos que la densidad del Universo es hoy día de poco más de 1 átomo por m3 de espacio.

Traducida en una medida de las distancias medias entre estrellas o galaxias, esta densidad tan baja muestra porque no es tan sorprendente que otros sistemas estelares estén tan alejados y sea difícil el contacto con extraterrestres. Si existen en el Universo otras formas de vida avanzada (como creo), entonces, al igual que los seres de la Tierra habrán evolucionado sin ser perturbadas por los seres de otros mundos hasta que puedan llegar a lograr una fase tecnológica avanzada.
Además, la muy baja temperatura de la radiación hace algo más que asegurar que el espacio sea un lugar frío: también garantiza la oscuridad del cielo nocturno. Durante siglos los científicos se han preguntado por esta sorprendente característica del Universo. Si ahí fuera en el espcio hubiera un número enorme de estrellas, entonces cabría pensar que mirar hacia arriba al cielo nocturno sería un poco como mirar un bosque denso.

Millones de estrellas en un sólo cúmulo globular
Cada linea de visión debería terminar en una estrella. Sus superficies brillantes cubrirían cada parte del cielo haciéndolo parecido a la superficie del Sol. Lo que nos salva de ese cielo brillante es la expansión del Universo y la lejanía a la que se encuentran las estrellas entre sí. Para encontrar las condiciones necesarias que soporte la complejidad viviente hicieron falta diez mil millones de años de expansión y enfriamiento.
La Densidad de materia ha caido hasta un valor tan bajo que aun sim toda la materia se transformase repentinamente en energía radiante no advertiríamos ningún resplandor importante en el cielo nocturno. La radiación es demasiado pequeña y el espacio a llenar demasiado grande para que el cielo parezca brillante otra vez. Hubo un tiempo cuando el Universo era mucho más jovencito, menos de cien mil años, en que todo el cielo era brillante, tan brillante que ni estrellas ni átomos ni moléculas podían existir, la podría radiación los destruía. Y, en ese tiempo, no podrían haber exististido observadores para ser testigo de ello.
![[ic2118_dss.jpg]](http://2.bp.blogspot.com/_xBXZbW6ivIs/SOKQIm3H-hI/AAAAAAAACVQ/zaYTtkavd_M/s1600/ic2118_dss.jpg)
Con algunas estrellas por aquí y por allá, alguna que otra Nebulosa (incluso algunas brujas), el Universo es oscuro y frío.
Pero estas consideraciones tienen otros resultados de una Naturaleza mucho más filosófica. El gran tamaño y la absoluta oscuridad del Universo parecen ser profundamente inhóspitos para la vida. La apariencia del cielo nocturno es responsable de muchos anhelos religiosos y estéticos surgidos de nuestra aparente pequeñez e insignificancia frente a la grandeza e inmutabilidad (aparente) de las estrellas lejanas. Muchas Civilizaciones rindieron culto a las estrellas o creyeron que gobernaban su futuro, mientras otras, como la nuestra, a menudo anhelan visitarlas.
Mucho se ha escrito sobre el efecto emocional que produce la contemplación de la insignificancia de la Tierra ante esa inmensidad del cielo salpicado de estrellas, inmersa en una Galaxia que tiene más de cien mil millones y que ahora sabemos, que también tiene, miles de millones de mundos. En efecto, la idea de ese conocimiento es impresionante y puede llegar (en algunos casos) a ser intensamente desagradable y producir sensación de ahogo y hasta miedo. Nuestra imaginación matemática se ve atormentada ante esa inconmensurable grandeza que, nuestras mentes, no llegan a poder asimilar. Y, la sorpresa llegó cuando pudimos descubrir que dentro de nuestro Universo, existía otro a escala infinitesimal que planteaba preguntas que no sabíamos responder.
“Pues bien, tratando de responder a estas preguntas es como nace The Scale of The Universe 2, una visualización interactiva creada por Cary y Michael Huang; la visualización es sorprendente porque nos permite ir a escalas mínimas y llegar hasta el tamaño aproximado del Universo, comparando cosas que están, de muchas maneras, más allá de nuestra imaginación (sigo pensando que es difícil imaginarse el tamaño real de un átomo, o el de una galaxia).”

Claro que, en eso de lo grande y lo pequeño…, todo puede ser muy subjetivo y, no pocas veces dependerá de la perspectiva con que lo podamos mirar. Podríamos considerar la Tierra como enorme, al mirarla bajo el punto de vista que es el mundo que nos acoge, en el que existen inmensos océanos y grandes montañas y volcanes y llanuras y bosques y ríos y, una inmensa lista de seres vivos. Sin embargo, se nos aparecerá en nuestras mentes como un minúsculo grano de arena y agua si la comparamos a la inmensidad del Universo. Igualmente, podemos ver un átomo como algo grande en el sentido de que, al juntarse con otros, pueden llegar a formar moléculas que juntas, son capaces de formar mundos y galaxias.

Si comparamos una galaxia con un átomo, éste nos parecerá algo ínfimo. Si comparamos esa misma galaxia con el Universo, lo que antes era muy grande ahora resulta ser también muy poca cosa. Si el mundo que nos acoge, en el que la Humanidad ha escrito toda su historia y costado milenios conocer, dado su “inmensidad” para nosotros, lo comparamos con la Nebulosa Orión, nos parecerá ridículo en tamaño y proporción y, sin embargo, cuán importante es para nosotros. Todo puede ser grande o pequeño dependiendo de la perspectiva con que lo miremos y según con qué lo podamos comparar.
Nada es objetivamente grande; las cosas son grandes sólo cuando consiguen tocar la sensibilidad del observador que las contempla, encontrar los caminos hacia su corazón y su cerebro. La idea de que el Universo es una multitud de esferas minúsculas circulando como motas de polvo en un vacío oscuro e ilimitado, podría dejarnos fríos e indiferentes, si no acomplejados y deprimidos, si no fuera porque nosotros identificamos este esquema hipotético con el esplendor visible, la intensidad conmovedora del desconcertante número de estrellas que están ahí, precisamente, para hacer posible nuestra presencia aquí y, eso amigos míos, nos hace ser importantes, dado que demuestra algo irrefutable, formamos parte de toda esta grandeza.

Bueno, no es por nada pero, ¿quién me puede decir que una imagen como la que arriba podemos contemplar, no es tan hermosa como la más brillante de las estrellas del cielo? Incluso diría que más, ya que se trata del producto o esencia del material que allí se fabricó y que ha podido llegar a su más alto nivel de belleza que, además, tiene consciencia de Ser y genera pensamientos y, ¡sentimientos!

Somos parte del Universo… ¿La que piensa? La que se puso aquí para hacer preguntas y buscar respuestas? Puede ser que algún día (si la Naturaleza nos respeta como especie) podamos contestar estas preguntas que hoy, están profundamente ocultas.
Yo, si tengo que deciros la verdad, no me considero nada insignificante, soy consciente de que formo parte del Universo, como todos ustedes, ni más ni menos, somos una parte de la Naturaleza y, como tales productos de algo tan grande, debemos estar orgullosos y, sobre todo procurar, conocer bien qué es lo que realmente hacemos aquí, para qué se nos han traído y, para ello amigos, el único camino que conozco es, llegar a conocer a fondo la Naturaleza y procurar desvelar sus secretos, ella nos dirá todo cuanto queramos saber.
emilio silvera
Oct
31
Objetos, moléculas, agregados, sustancias…Materia… Y,...
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Tenemos que saber ~
Clasificado en Tenemos que saber ~
 Comments (1)
Comments (1)

En los organismos se encuentran cuatro tipos diferentes de moléculas orgánicas en gran cantidad: carbohidratos, lípidos, proteínas y nucleótidos. Todas estas moléculas contienen carbono, hidrógeno y oxígeno. Además, las proteínas contienen nitrógeno y azufre, y los nucleótidos, así como algunos lípidos, contienen nitrógeno y fósforo. Se ha dicho que es suficiente reconocer cerca de 30 moléculas para tener un conocimiento que permita trabajar con la bioquímica de las células. Dos de esas moléculas son los azúcares glucosa y ribosa; otra, un lípido; otras veinte, los aminoácidos biológicamente importantes; y cinco las bases nitrogenadas, moléculas que contienen nitrógeno y son constituyentes claves de los nucleótidos. En esencia, la química de los organismos vivos es la química de los compuestos que contienen carbono o sea, los compuestos orgánicos.

Modelos de esferas y varillas y fórmulas estructurales del metano, etano y butano.
Las propiedades químicas específicas de una molécula orgánica derivan principalmente de los grupos de átomos conocidos como grupos funcionales. Estos grupos están unidos al esqueleto de carbono, reemplazando a uno o más de los hidrógenos que estarían presentes en un hidrocarburo.
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.

Podemos encontrar numerosos tipos de silicio, ácido silícico, ortosilícico, dióxido de silicio, silicio coloidal, silanol, etc.
El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor. Refiriéndonos al silicio, que para nosotros es el más importante, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

Las propiedades químicas específicas de una molécula orgánica derivan principalmente de los grupos de átomos conocidos como grupos funcionales. Estos grupos están unidos al esqueleto de carbono, reemplazando a uno o más de los hidrógenos que estarían presentes en un hidrocarburo
El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.

Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.


No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El de las primeras es enormemente inferior al de las segundas.
Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.
“La temperatura de un gas monoatómico es una medida relacionada con la energía cinética promedio de sus moléculas al moverse. En esta animación, la relación del tamaño de los átomos de helio respecto a su separación se conseguiría bajo una presión de 1950 atmósferas. Estos átomos a temperatura ambiente tienen una cierta velocidad media (aquí reducida dos billones de veces).”
¿Y la teoría cinética molecular? Si, también está presente en las nebulosas y actúa conforme a las temperaturas allí reinantes y a los vientos estelares emitidos por estrellas nuevas.
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece desde el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).

Si las temperaturas reinantes, como decíamos en páginas anteriores, es de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.

El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina. Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.

Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
Hablando de átomos y moléculas estamos hablando de ese “universo” de lo muy pequeño”, ese lugar que estando en nuestro “mundo” parece que está en otro, toda vez que, su infinitesimales medidas, no hacen posible que el ojo lo pueda contemplar a simple vista y, para saber que están ahí, nos valemos de experimentos de altas energías en aceleradores de partículas.

El mundo de lo muy pequeño (el micro espacio), a nivel atómico y subatómico, es el dominio de la física cuántica, así nunca podríamos saber, de acuerdo m con el principio de incertidumbre, y, en un momento determinado, la posición y el estado de una partícula. Este estado podría ser una función de la escala espacio-temporal. A esta escala tamaños todo sucede demasiado deprisa para nosotros.

El “universo cuántico” nada es lo que parece a primera vista, allí entramos en otro mundo que en nada, se parece al nuestro
Cuando hablamos de la mecánica cuántica, tenemos mirar un poco hacia atrás en el tiempo y podremos darnos del gran impacto que tuvo en el devenir del mundo desde que, en nuestras vidas, apareció el átomo y, más tarde, sus contenidos. Los nombres de Planck, Einstein, Bohr, Heisenberg, Schrödinger, Pauli, Bardeen, Roentgen, Dirac y muchos otros, se pudieron a la cabeza de la lista de las personas más famosas. Aquel primer premio Nobel de Física otorgado en 1900 a Roentgen por descubrir los rayos X, en el mismo año llegaría el ¡cuanto! De Planck que inspiró a Einstein para su trabajo sobre el Efecto fotoeléctrico que también, le valdría el Nobel, y, a partir de ese momento, se desencadenó una especie de alucinante por saber sobre el átomo, sus contenidos, y, de qué estaba hecha la materia.
La conocida como Paradoja EPR y los conceptos de Tiempo y , presente, pasado y futuro
Fueron muchas las polémicas desatadas a cuenta de las aparentes incongruencias de la moderna Mecánica Cuántica. La paradoja de Einstein-Podolsky-Rosen, denominada “Paradoja EPR”, trata de un experimento mental propuesto por Albert Einstein, Boris Podolsky y Nathan Rosen en 1935. Es relevante, pues pone de manifiesto un problema aparente de la mecánica cuántica, y en las décadas siguientes se dedicaron múltiples esfuerzos a desarrollarla y resolverla.
A Einstein (y a muchos otros científicos), la idea del entrelazamiento cuántico le resultaba extremadamente perturbadora. Esta particular característica de la mecánica cuántica permite preparar estados de dos o más partículas en los cuales es imposible obtener útil sobre el estado total del sistema haciendo sólo mediciones sobre una de las partículas.

Por otro lado, en un entrelazado, manipulando una de las partículas, se puede modificar el estado total. Es decir, operando sobre una de las partículas se puede modificar el estado de la otra a distancia de manera instantánea. Esto habla de una correlación entre las dos partículas que no tiene paralaje en el mundo de nuestras experiencias cotidianas. Cabe enfatizar pues que cuando se mide el estado de una partícula, enseguida sabemos el estado de la otra, lo cual aparentemente es instantáneo, es decir, sin importar las distancias a las que se encuentren las partículas, una de la otra, ambas saben instantáneamente el estado de la otra.
El experimento planteado por EPR consiste en dos partículas que interactuaron en el pasado y que quedan en un estado entrelazado. Dos observadores reciben cada una de las partículas. Si un observador mide el momento de una de ellas, sabe cuál es el momento de la otra. Si mide la posición, gracias al entrelazamiento cuántico y al principio de incertidumbre, puede la posición de la otra partícula de forma instantánea, lo que contradice el sentido común.

Animación que muestra dos átomos de oxígeno fusionándose para formar una molécula de O2 en su estado cuántico fundamental. Las nubes de color representan los orbitales atómicos. Los orbitales 2s y 2p de cada átomo se combinan para formar los orbitales σ y π de la molécula, que la mantienen unida. Los orbitales 1s, más interiores, no se combinan y permiten distinguir a cada núcleo. Lo que ocurre a escalas tan pequeñas es fascinante.
Si nos pudiéramos convertir en electrones, por ejemplo, sabríamos dónde y cómo estamos en cada momento y podríamos ver asombrados, todo lo que estaba ocurriendo a nuestro alrededor que, entonces sí, veríamos transcurrir a un ritmo más lento del que podemos detectar en los electrones desde nuestro macroestado espacio temporal. El electrón, bajo nuestro punto de vista se mueve alrededor del núcleo atómico a una velocidad de 7 millones de km/h.
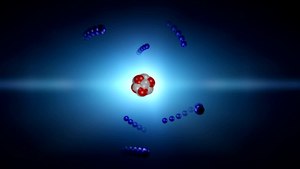
A medida que se asciende en la escala de tamaños, hasta el tiempo se va ajustando a esta escala, los objetos, a medida que se hacen mayores se mueven más despacio y, además, tienen más duración que los pequeños objetos infinitesimales del micro mundo cuántico. La vida media de un neutron es de unos 15 minutos, por ejemplo, mientras que la vida media de una estrellas se puede contar en miles de millones de años.
En nuestra macroescala, los acontecimientos y ,los objetos se mueven a velocidades que a nosotros nos parecen normales. Si se mueven con demasiada lentitud nos parece que no se mueven. Así hablamos de escala de tiempo geológico, para referirnos al tiempo y velocidad de la mayor parte de los acontecimientos geológicos que afectan a la Tierra, el tiempo transcurre aquí en millones de años y nosotros ni lo apreciamos; nos parece que todo está inmóvil. Nosotros, los humanos, funcionamos en la escala de años (tiempo biológico).

El Tiempo Cosmológico es aún mucho más dilatado y los objetos cósmicos (mundos, estrellas y galaxias), tienen una mayor duración aunque su movimiento puede ser muy rápido debido a la inmensidad del espacio universal en el que se mueven. La Tierra, por ejemplo, orbita alrededor del Sol a una velocidad media de 30 Km/s., y, el Sol, se desplaza por la Galaxia a una velocidad de 270 km/s. Y, además, se puede incrementar el tiempo y el espacio en su andadura al estar inmersos y ligados en una misma maya elástica.
Así, el espacio dentro de un átomo, es muy pequeño; dentro de una célula, es algo mayor; dentro de un animal, mayor aún y así sucesivamente… hasta llegar a los enormes espaciosa que separan las estrellas y las galaxias en el Universo.

Distancias astronómicas separan a las estrellas entre sí, a las galaxias dentro del cúmulo, y a los cúmulos en los supercúmulos.
Las distancias que separan a los objetos del Cosmos se tienen que medir con unidades espaciales, tal es su inmensa magnitud que, nuestras mentes, aunque podamos hablar de ellas de manera cotidiana, en realidad, no han llegado a asimilarlas.Y, a todo ésto, los físicos han intentado con denuedo elaborar una teoría completa de la gravedad que incluya la mecánica cuántica. Los cálculos de la mayoría de las teorías propuesta de la «gravedad cuántica» arrojan numerosos infinitos. Los físicos no están seguros si el problema es técnico o conceptual. No obstante, incluso prescindiendo de una teoría completa de gravedad cuántica, se puede deducir que los efectos de la teoría cuántica, habrían cruciales durante los primeros 10-43 segundos del inicio del universo, cuando éste tenía una densidad de 1093 gramos por centímetro cúbico y mayor.

(El plomo sólido tiene una densidad de aproximadamente diez gramos por centímetro cúbico.) Este período, que es el que corresponde a la era de Planck, y a su estudio se le llama cosmología cuántica. Como el universo en su totalidad habría estado sujeto a grandes incertidumbres y fluctuaciones durante la era de Planck o era cuántica, con la materia y la energía apareciendo y desapareciendo de un vacío en grandes cantidades, el concepto de un principio del universo podría no tener un significado bien definido. En todo caso, la densidad del universo durante este período es de tal magnitud que escapa a nuestra comprensión. Para propósitos prácticos, la era cuántica podría considerarse el estado inicial, o principio, del universo. En consecuencia, los procesos cuánticos ocurridos durante este período, cualquiera sea su naturaleza, determinaron las iniciales del universo.

Una cosa nos ha podido quedar clara: Los científicos para lograr conocer la estructura del universo a su escala más grande, deben retroceder en el tiempo, centrando sus teorías en el momento en que todo comenzó. Para ello, como todos sabeis, se han formulado distintas teorías unificadoras de las cuatro fuerzas de la naturaleza, con las cuales se han modelado acontecimiento y en el universo primitivo casi a todo lo largo del camino hasta el principio. Pero cómo se supone que debió haber habido un «antes», aparece una barrera que impide ir más allá de una frontera que se halla fijada a los 10-43 [s] después del Big Bang, un instante conocido como «momento de Planck», en homenaje al físico alemán Max Planck.

Esta barrera existe debido a que antes del momento de Planck, durante el período llamado la «era de Planck o cuántica», se supone que las cuatro fuerza fundamentales conocidas de la naturaleza eran indistinguibles o se hallaban unificadas , que era una sola fuerza. Aunque los físicos han diseñado teorías cuánticas que unen tres de las fuerzas, una por una, a través de eras que se remontan al momento de Planck, hasta ahora les ha prácticamente imposible armonizar las leyes de la teoría cuántica con la gravedad de la relatividad de Einstein, en un sólo modelo teórico ampliamente convincente y con posibilidades claras de ser contrastado en experimentos de laboratorio y, mucho menos, con observaciones.
Y después de todo ésto, sólo una caso me queda clara: ¡Lo poco que sabemos! A pesar de la mucha imaginación que ponemos en las cosas que creemos conocer.
emilio silvera
Oct
17
Curiosidades
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Tenemos que saber ~
Clasificado en Tenemos que saber ~
 Comments (1)
Comments (1)
La increíble historia de los ríos del Sistema Solar.

Tres mundos, Marte, Titán y la Tierra tienen corrientes. Sus huellas sirven para reconstruir la historia geológica
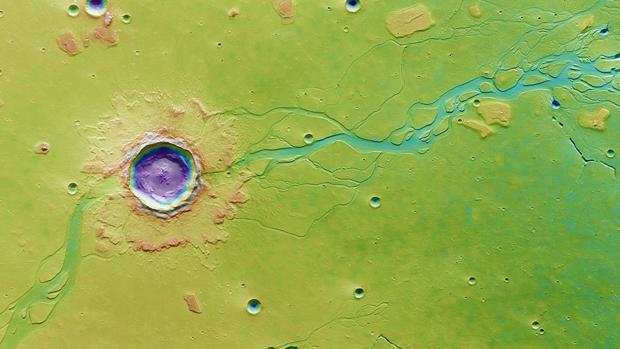
Un gran impacto sacó a la luz el hielo de agua del subsuelo de Marte y creó una inundación – ESA
El Sistema Solar es un lugar repleto de historia, cuyos capítulos pueden leerse en la piel de los planetas y los satélites rocosos. Este cuento habla de un pasado convulso en Marte, donde un gran movimiento de la corteza creó la enorme depresión de Valle Marineris (que es cinco veces más profundo y casi diez veces más largo que el gran cañón del Colorado). También cuenta la historia de Venus, un planeta recorrido por corrientes de lava y volcanes, que hoy descansan bajo una atmósfera de ácido sulfúrico. E incluso en aquellos mundos cuya piel está repleta de cráteres de asteroides, la historia habla de planetas muertos, que perdieron su actividad geológica hace miles de millones de años.

Imagen de una región de Marte

Discurrir de los ríos entre montañas en la Tierra

También en Titán, además del metano, existen correntías de agua
Hay tres mundos en el Sistema Solar, Marte, Titán y la Tierra, que tienen o han tenido ríos fluyendo en su superficie. Este jueves, científicos del Instituto Tecnológico de Massachusetts (MIT) han presentado un estudio en Science donde han comparado los ríos de estos planetas. Su objetivo ha sido aprovechar lo mucho que se sabe sobre la topografía de Marte y la Tierra para entender mejor el pasado de Titán, el satélite de Saturno. Así, han concluido que los paisajes de este son fruto de un pasado sin actividad tectónica reciente, al igual que ocurre con Marte, y al contrario que pasa con la Tierra.
«Es muy destacable que solo haya tres mundos en el Sistema Solar en los que los ríos hayan tallado el paisaje, o en el presente o en el pasado», ha dicho Taylor Perron, coautor del estudio e investigador en el MIT. «Por eso es una oportunidad increíble usar las huellas creadas por los ríos para aprender las historias por las cuales esos planetas son diferentes».

Por eso, tanto Taylor Perron como Benjamin Black, profesor en la City College de Nueva York (EE.UU.), trataron de averiguar más sobre la historia de Titán y sus ríos aplicando lo que se sabe sobre la topografía de la Tierra y Marte. «Aunque los procesos que han creado la topografía de Titán son todavía un enigma, ahora sabemos que no tienen nada que ver con los mecanismos con los que estamos familiarizados en la Tierra», ha dicho Black.
Los autores compararon con gran precisión la topografía de los ríos presentes de la Tierra y Titán, y de los ríos pasados de Marte, usando los mapas con la mejor resolución disponible. Los modelos que elaboraron, podrían ser aplicados a otros planetas para reconstruir su geología.
Huellas en los ríos

Me gustaría a mi saber, lo que puede existir en el subsuelo de Marte, que rico en actividad volcánica en su pasado, tiene inmensas grutas en las, situadas muy por debajo de la superficie, en el pasado corría la lava candente y hoy, podría correr el agua líquida precursora de la Vida.

Hasta que no vayamos a Marte y entremos en el subsuelo no podremos encontrar la vida allí presente
El agua siempre fluye a favor de pendiente. Pero puede ocurrir que la cuencas de drenaje basculen hacia el sur, y los ríos estén excavados en la roca de forma que fluyan hacia el norte. Este fenómeno ocurre en la Tierra gracias al dinamismo de su geología, y en especial de las placas tectónicas, que cambia el perfil del suelo rápidamente, en la escala geológica.
Ni en Marte ni en Titán ocurre lo mismo, según los autores. Los cambios topográficos son allí más coherentes con el cauce de los ríos, según los modelos de Black, y las excepciones están relacionadas con fenómenos puntuales, como pueden ser los cráteres de impacto de los asteroides.

La superficie y la atmósfera de Titán
A la vista de las conclusiones obtenidas al analizar los ríos, los autores concluyeron que el paisaje de Titán, que apenas se puede imaginar bajo la gruesa atmósfera y los perfiles obtenidos por radar por la nave Cassini, se parece más a Marte que al de la Tierra. «Titán parece tener amplios valles y colinas, que podrían haberse formado hace bastante tiempo, de forma que los ríos han estado erosionándolos desde entonces. No como en la Tierra, donde han surgido nuevas cordilleras cada cierto tiempo, con ríos constantemente luchando contra ellas», ha resumido Perron.
La piel cambiante de los planetas

En transcurrir del Tiempo lo cambia todo y, los planetas, como todo lo demás en el Universo, no son una excepción, cambian y evolucionan de manera tal que, mañana serán distintas al presente.

Titán es un satélite de Saturno envuelto en una gruesa atmósfera, rica en nitrógeno. Aunque su superficie ronda los 180 grados centígrados bajo cero, este mundo alberga un ciclo climático complejo: en su superficie hay metano líquido que forma lagos que no tienen nada que envidiar a los terrestres. Una parte del metano se evapora y pasa a la atmósfera, y como regresa al suelo en forma de lluvia, esta molécula crea auténticos ríos «titánicos» sobre el hielo y la roca del satélite.
Por ejemplo, uno de ellos es Vid Flumina, una corriente de 400 kilómetros de longitud que desemboca en el lago Ligeia Mare y que lleva el nombre de un río venenoso de la mitología nórdica. Este lago, por su parte, es mayor que el lago Superior, en América del Norte, y tiene una orilla de unos 2.000 kilómetros de largo.

A lo largo de miles de millones de años, la Tierra ha cambiado su piel. Los continentes se han movido sobre las placas tectónicas. La mayoría de las rocas más antiguas y de los fósiles de formas de vida más primitivas han desaparecido en el subsuelo, y continentes enteros se han sumergido. Han nacido islas y montañas, y los ríos han ido cambiando su curso.
Pero en Marte, cuya vida se congeló hace miles de millones de años, la historia ha sido diferente. La quietud de la superficie ha dejado a la vista el perfil de antiguos cráteres. Aunque su atmósfera desapareció, el cauce de los ríos permanece casi intacto desde entonces.

Los autores pueden usar estos análisis del curso de los ríos para distinguir si algunas regiones de los planetas están sufriendo más deformaciones que otras. Además, sugieren que también permitirían estudiar canales de lava en Venus y posibles restos de redes fluviales presentes en Plutón.

Decían por aquel entonces: Cuando en septiembre la sonda Cassini desaparezca en el planeta Saturno, los científicos se quedarán sin ojos en el gigante gaseoso y sus increíbles lunas. Dos de ellas, Encélado y Titán, son dos objetivos de alta prioridad para la búsqueda de vida extraterrestre. Conocer todo lo posible sobre su superficie y su historia será fundamental para entender los grandes cuentos de la vida y del Sistema Solar. Para ello, no solo es crucial estudiar los paisajes, sino también las huellas dejadas por los ríos.
Jul
25
Como los niños: ¡Siempre haciendo prguntas!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Tenemos que saber ~
Clasificado en Tenemos que saber ~
 Comments (0)
Comments (0)
Hagamos un viaje por las posibilidades de encontrar nuevas clases de energías…

En esta preciosa región de formación de nuevos astros, podemos contemplar esa rutilante y cegadora estrella que ramifica su esplendor hasta distancias inauditas. En su corazón, en el núcleo central, se está produciendo la fusión del hidrógeno en helio y… Pero vayamos por .
Resulta que el combustible nuclear de las estrellas es el hidrógeno que mediante su fusión hace posible que genere tal enormidad de energía. El Sol, la estrella más cercana a nosotros y que hace posible la vida en el planeta Tierra, fusiona 4.654.000 Toneladas de Hidrógeno en 4.650.000 toneladas de helio cada segundo. Las 4.000 toneladas restantes, se expulsa al espacio en de luz y calor, de lo que una pequeña fracción, llega a nosotros. Así lleva el Sol unos 4.500 millones de años y se espera que al menos durante un período similar nos esté regalando su preciosa energía. Si eso es así (que lo es), yo aconsejaría a los madatarios de nuestro planeta, copiar a la naturaleza y procurar un suministro de energía siguiendo el mismo camino del Sol, si podemos conseguir duplicar aquí en la Tierra sus mecanismos, conseguiríamos una fuente de energía de la que tanto estamos necesitados.
Pero ¿tenemos hidrógeno en el planeta Tierra tal empresa de fusión nuclear?

La verdad es que sí. La fuente de suministro de hidrógeno con la que podemos contar es prácticamente inagotable… Nuestro planeta, en su mayor está formado por grandes mares y oceános y, siendo así, el material primario que necesitamos es…
¡El agua de los mares y de los océanos!
Todos sabemos que el hidrógeno es el elemento más ligero y abundante del universo. Está presente en el agua y en todos los compuestos orgánicos. Químicamente, el hidrógeno reacciona con la mayoría de los elementos. Fue descubierto por Henry Cavendisch en 1.776. El hidrógeno se utiliza en muchos procesos industriales, como la reducción de óxidos minerales, el refinado del petróleo, la producción de hidrocarburos a partir de carbón y la hidrogenación de los aceites vegetales y, actualmente, es un candidato muy firme su uso potencial en la economía de los combustibles de hidrógeno en la que se usan fuentes primarias distintas a las energías derivadas de combustibles fósiles (por ejemplo, energía nuclear, solar o geotérmica) para producir electricidad, que se emplea en la electrólisis del agua. El hidrógeno formado se almacena como hidrógeno líquido o como hidruros de metal.

Inmensas energías desatadas por todo el Universo, miríadas de estrellas en las galaxias que producen sin cesar, luz y calor que mantiene vivo el fuego de los posibles hogares de muchos mundos que podrían ser.
Bueno, tantas explicaciones sólo tienen como objeto notar la enorme importancia del hidrógeno. Es la materia prima del universo, sin él no habría estrellas, no existiría el agua y, lógicamente, tampoco nosotros podríamos estar aquí sin ese preciado elemento. Cuando dos moléculas de hidrógeno se junta con una de oxígeno (H2O), tenemos el preciado líquido que llamamos agua y sin el cual la vida no sería posible.
Así las cosas, parece lógico pensar que conforme a todo lo antes dicho, los seres humanos deberán fijarse en los procesos naturales (en este caso el Sol y su producción de energía) y, teniendo como tiene a su disposición la materia prima (el hidrógeno de los océanos), procurar investigar y construir las máquinas que sean necesarias conseguir la fusión, la energía del Sol.
Esa empresa está ya en marcha y, posiblemente, en unos treinta años sería una realidad que nos dará nuevas perspectivas para el imparable avance en el que estamos inmersos.

Fusión de Deuterio con Tritio produciendo helio-4 liberando un neutrón, y generando 17,59 MeV de energía, como cantidad de masa apropiada convertida de la energía cinética de los productos, de acuerdo con E = Δm c2. En física nuclear , la fusión nuclear es el proceso por el cual varios núcleos atómicos de carga similar se unen para formar un núcleo más pesado. Se acompaña de la liberación o absorción de una cantidad enorme de energía, que permite a la materia entrar en un plasmático.

Instalación para fusión nuclear
Este proceso puede liberar enormes cantidades de energía. Sin embargo el proceso no es tan simple, requiere de una enorme energía de activación a una temperatura del orden de los millones de grados. De haber energía, surge otra dificultad: la estructura material de un reactor puede fundirse a tan elevada temperatura.
No debemos confundir la Fisión con la Fusión, la primera es la que se emplea en las Centrales nucleares para producir energía y, ya sabemos todo lo peligrosa que resulta (Japón, en sus propias carnes ha sufrido y sufre sus consecuencias), las radiaciones del Uranio y del Plutonio son fatales para la vida. Por el contrario, la fusión es limpia pero de …, inalcanzable…para nosotros.

En cuanto nuestra tecnología nos lo permita, tenemos que huir de la escena que arriba contemplamos, la Fisión nuclear no es la solución.

En el proceso de la fusión Solar está la respuesta
Pero no me gustaría cerrar este comentario sobre la fusión sin contestar a una importante pregunta…


Se continúa tratando de obtener la energía de fusión
El exitoso experimento alemán que acerca un poco más el sueño de energía limpia por fusión nuclear. Los avances logrados nos llevan a tener una gran esperanza en esa nueva energía para dentro de unos 30 años.
¿Por qué la fusión?
Porque tiene una serie de ventajas muy significativas en seguridad, funcionamiento, , facilidad en conseguir su materia prima, ausencia de residuos peligrosos, posibilidad de reciclar los escasos residuos que genere, etc.
- Los recursos combustibles básicos (deuterio y litio) la fusión son abundantes y fáciles de obtener.
- Los residuos son de helio, no radiactivos.
- El combustible intermedio, tritio, se produce del litio.
- Las centrales eléctricas de fusión no estarán expuestas a peligrosos accidentes como las centrales nucleares de fisión.
- Con una elección adecuada de los materiales para el propio dispositivo de fusión, sus residuos no serán ninguna carga para las generaciones futuras.
- La fuente de energía de fusión es sostenible, inagotable e independiente de las climáticas.

En Instalaciones como esta lo podremos lograr. De todas las maneras y a pesar de lo mucho que nuestras mentes pueden imaginar, no será fácil lograr, aquí en la Tierra, el mismo proceso que de forma natural se produce en nuestro Sol y en todas las estrellas que conforman las galaxias del universo, y, tantas dificultades se presentan para ello que, por eso, muchos hablan de la fusión fría. Lo que por otra parte, no deja de ser un hermoso sueño.
Para producir la energía de fusión “sólo” tenemos que copiar lo que hace el Sol. Tenemos que hacer chocar átomos ligeros de hidrógeno para que se fusionen entre sí a una temperatura de 15 millones de grados Celsius, lo que, en de altas presiones (como ocurre en el núcleo del Sol) produce enormes energías según la formula E = mc2 que nos legó Einstein demostrando la igualdad de la masa y la energía. Ese de la materia que se consigue a tan altas temperaturas, es el plasma, y sólo en ese se puede conseguir la fusión.
Aunque en Europa la aventura ya ha comenzado, y para ello se han unido los esfuerzos económicos de varias naciones, la empresa de dominar la fusión no es nada fácil, pero…, démosle… ¡TIEMPO!

Decir que algo es imposible, al ritmo que camina la ciencia… ¡Es muy arriesgado!
Sí, es el tiempo el factor que juega a nuestro favor para conseguir nuestros logros más difíciles, para poder responder preguntas de las que hoy no tenemos respuesta, y es precisamente la sabiduría que adquirimos con el paso del tiempo la que nos posibilita para hacer nuevas preguntas, más profundas que las anteriores y que antes, por ignorancia, no podríamos hacer. Cada nuevo conocimiento nos abre una puerta que nos invita a entrar en una nueva región donde encontramos otras puertas cerradas que tendremos que abrir para nuestro camino. Sin embargo, hasta ahora, con el “tiempo” suficiente para ello, hemos podido franquearlas hasta llegar al momento presente en el que estamos ante puertas cerradas con letreros en los que se puede leer: fusión, teoría M, viajes espaciales tripulados, nuevas formas de materia, el gravitón, la partícula de Higgs, las ondas de energía de los agujeros negros, hiperespacio, agujeros de gusano, otros universos, materia oscura y otras dimensiones.

¡Sueños de la Humanidad!
Claro que, de vez en , algúin que otro de esos sueños…, ¡se hace realidad!
Muchas son las puertas que permanecen cerradas y de las que no tenemos las llaves para poder acceder a los conocimientos que, celosamente guarda. Muchas nos quedan por abrir. Tenemos ante nuestras narices puertas cerradas que, encima de sus dinteles llevan letreros con los nombres de: Teoría de Cuerdas, multiversos, vida extraterrestre, genética, nanotecnología, nuevos fármacos, alargamiento de la vida media, y muchas más en otras ramas de la ciencia y del saber humano y, para lograr realidad esos sueños, sólo necesitamos ¡Tiempo!

Somos tan pequeños ante tan inmenso universo y, sin embargo…
- ¿Por qué consideramos que el tiempo rige nuestras vidas?
- ¿Cómo explicarías “qué es el tiempo”?
- ¿Por qué unas veces te parece que el tiempo “pasa rápido” y otras veces “muy lento”?
- ¿Crees que el tiempo estaba antes del Big Bang? ¿Por qué?
- ¿En algún se acabará el tiempo?
- ¿Cómo el ser humano “fue consciente” de la existencia del tiempo?
- ¿Qué cosa es el tiempo?
- ¿Por qué no lo vemos ni tocamos pero notamos sus efectos?
- ¿Por qué la velocidad relativista puede frenar el transcurrir del tiempo?
- ¿Es una abstracción el Tiempo que, en realidad no existe?

Nos hacemos preguntas y más preguntas que no sabemos contestar. Han pasado muchos periodos de tiempo que llegamos aquí, y la humanidad, aunque cometió muchos errores, en verdad, sí aprovechó el tiempo. No quiero decir que en todos los ámbitos humanos del comportamiento tengamos que felicitarnos, hay algunos (aún hoy) de los que el sonrojo es inevitable, pero eso es debido a que la parte animal que llevamos en nosotros está de alguna manera presente, y los instintos superan a veces a la racionalidad. Aún no hemos superado el proceso de humanización. Sin embargo, los logros conseguidos no han sido pocos; el “tiempo” está bien aprovechado si pensamos que hace sólo unos miles de años no sabíamos escribir, vagamos por los campos cazando y cogiendo frutos silvestres y no existían organizaciones sociales ni poblaciones. Desde entonces, el salto dado en todos los campos del saber ha sido tremendo.
Ahora, pasado el tiempo, nuestra innata curiosidad nos ha llevado a descubrir que vivimos en un planeta que pertenece a una estrella de una galaxia que forma parte de un grupo de una treintena de galaxias (el “Grupo Local”) y que a su vez, están inmersas en un universo que con decenas de miles de millones de galaxias como la nuestra.

Ese período de tiempo que hemos tenido que asombrados, mirábamos brillar las estrellas sobre nuestras cabezas sin saber lo que eran, o bien, asustados, nos encogíamos ante los rayos amenazadores de una tormenta o huíamos despavoridos ante el rugido aterrador de la Tierra con sus temblores de terremotos pavorosos o explosiones inmensas de enormes montañas que vomitaban fuego.
entonces, hemos aprendido a observar con atención, hemos desechado la superstición, la mitología y la brujería para atender a la lógica y a la realidad de los hechos. Aprendimos de nuestros propios errores y de la naturaleza. Y, ahora, pretenciosos, queremos imitar lo que hace el Sol y fabricar, aquí en nuestro planeta, su energía.
Las estrellas evolucionaron y en sus hornos nucleares se fabricaron elementos más complejos que el primario hidrógeno; con la fusión nuclear en las estrellas se fabricó helio, litio, magnesio, neón, carbono, oxigeno, etc, etc. Estas primeras estrellas brillaron durante algunos miles de millones de años y, finalmente, acabado su combustible nuclear, finalizaron su ciclo vital explotando como supernovas lanzando al espacio exterior sus capas más superficiales y lanzando materiales complejos que al inmenso cosmos para hacer posible el nacimiento de nuevas estrellas y planetas y… a nosotros, que sin esas primeras estrellas que fabricaron los materiales complejos de los que estamos hecho, no estaríamos aquí.

NGC 7000
Todo eso hemos llegado a saber y hemos aprendido a observar con atención, hemos desechado la superstición, la mitología y la brujería para atender a la lógica y a la realidad de los hechos. Aprendimos de nuestros propios errores y de la naturaleza.
tiempos inmemoriales hemos querido medir el tiempo, el día y la noche, las estaciones, el sol, relojes de arena, etc, etc, hasta llegar a sofisticados aparatos electrónicos o atómicos que miden el tiempo cotidiano de los humanos con una exactitud de sólo un retrazo de una millonésima de un segundo cada 100 años.

Pero como todo avanza de manera exponencial, ahora se ha construido un nuevo reloj atómico la precisión de este reloj atómico se apoya en que los átomos de estroncio que oscilan 431 billones de veces por segundo.
Tendrían que pasar 15.000 millones de años para que el nuevo reloj atómico creado por físicos de EE UU retrasara un segundo. Para hacerse una idea, la edad del universo apenas llega a los 14.000 millones de años. El reloj ofrece tal precisión y estabilidad que podrían alumbrar descubrimientos científicos ni siquiera aún imaginados.
Algunas veces pienso y me pregunto: ¿Hasta donde llegaremos, dónde está el límite? Después de pensar detenida y profundamente, me llega la respuesta:
¡No hay límites!
emilio silvera
May
20
CURIOSIDADES
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Tenemos que saber ~
Clasificado en Tenemos que saber ~
 Comments (0)
Comments (0)
SCIENCE-ABC
La increíble historia de los ríos del Sistema Solar
Tres mundos, Marte, Titán y la Tierra tienen corrientes. Sus huellas sirven para reconstruir la historia geológica

Un gran impacto sacó a la luz el hielo de agua del subsuelo de Marte y creó una inundación – ESA
El Sistema Solar es un lugar repleto de historia, cuyos capítulos pueden leerse en la piel de los planetas y los satélites rocosos. Este cuento habla de un pasado convulso en Marte, donde un gran movimiento de la corteza creó la enorme depresión de Valle Marineris (que es cinco veces más profundo y casi diez veces más largo que el gran cañón del Colorado). También cuenta la historia de Venus, un planeta recorrido por corrientes de lava y volcanes, que hoy descansan bajo una atmósfera de ácido sulfúrico. E incluso en aquellos mundos cuya piel está repleta de cráteres de asteroides, la historia habla de planetas muertos, que perdieron su actividad geológica hace miles de millones de años.

Imagen de una región de Marte

Discurrir de los ríos entre monteñas en la Tierra

También en Titán, además del metano, existen correntías de agua
Hay tres mundos en el Sistema Solar, Marte, Titán y la Tierra, que tienen o han tenido ríos fluyendo en su superficie. Este jueves, científicos del Instituto Tecnológico de Massachusetts (MIT) han presentado un estudio en Science donde han comparado los ríos de estos planetas. Su objetivo ha sido aprovechar lo mucho que se sabe sobre la topografía de Marte y la Tierra para entender mejor el pasado de Titán, el satélite de Saturno. Así, han concluido que los paisajes de este son fruto de un pasado sin actividad tectónica reciente, al igual que ocurre con Marte, y al contrario que pasa con la Tierra.
«Es muy destacable que solo haya tres mundos en el Sistema Solar en los que los ríos hayan tallado el paisaje, o en el presente o en el pasado», ha dicho Taylor Perron, coautor del estudio e investigador en el MIT. «Por eso es una oportunidad increíble usar las huellas creadas por los ríos para aprender las historias por las cuales esos planetas son diferentes».

Por eso, tanto Taylor Perron como Benjamin Black, profesor en la City College de Nueva York (EE.UU.), trataron de averiguar más sobre la historia de Titán y sus ríos aplicando lo que se sabe sobre la topografía de la Tierra y Marte. «Aunque los procesos que han creado la topografía de Titán son todavía un enigma, ahora sabemos que no tienen nada que ver con los mecanismos con los que estamos familiarizados en la Tierra», ha dicho Black.
Los autores compararon con gran precisión la topografía de los ríos presentes de la Tierra y Titán, y de los ríos pasados de Marte, usando los mapas con la mejor resolución disponible. Los modelos que elaboraron, podrían ser aplicados a otros planetas para reconstruir su geología.
Huellas en los ríos

Me gustaría a mi saber, lo que puede existirt en el subsuelo de Marte, que rico en actividad volcánica en su pasado, tiene inmensas grutas en las, situadas muy por debajo de la superficie, en el pasado corría la lava candente y hoy, podría correr el agua líquida precursora de la Vida.
El agua siempre fluye a favor de pendiente. Pero puede ocurrir que la cuencas de drenaje basculen hacia el sur, y los ríos estén excavados en la roca de forma que fluyan hacia el norte. Este fenómeno ocurre en la Tierra gracias al dinamismo de su geología, y en especial de las placas tectónicas, que cambia el perfil del suelo rápidamente, en la escala geológica.
Ni en Marte ni en Titán ocurre lo mismo, según los autores. Los cambios topográficos son allí más coherentes con el cauce de los ríos, según los modelos de Black, y las excepciones están relacionadas con fenómenos puntuales, como pueden ser los cráteres de impacto de los asteroides.
A la vista de las conclusiones obtenidas al analizar los ríos, los autores concluyeron que el paisaje de Titán, que apenas se puede imaginar bajo la gruesa atmósfera y los perfiles obtenidos por radar por la nave Cassini, se parece más a Marte que al de la Tierra. «Titán parece tener amplios valles y colinas, que podrían haberse formado hace bastante tiempo, de forma que los ríos han estado erosionándolos desde entonces. No como en la Tierra, donde han surgido nuevas cordilleras cada cierto tiempo, con ríos constantemente luchando contra ellas», ha resumido Perron.
La piel cambiante de los planetas

En transcurrir del Tiempo lo cambia todo y, los planetas, como todo lo demás en el Universo, no son una excepción, cambian y evolucionan de manera tal que, mañana serán distintas al presente.
Titán es un satélite de Saturno envuelto en una gruesa atmósfera, rica en nitrógeno. Aunque su superficie ronda los 180 grados centígrados bajo cero, este mundo alberga un ciclo climático complejo: en su superficie hay metano líquido que forma lagos que no tienen nada que envidiar a los terrestres. Una parte del metano se evapora y pasa a la atmósfera, y como regresa al suelo en forma de lluvia, esta molécula crea auténticos ríos «titánicos» sobre el hielo y la roca del satélite.
Por ejemplo, uno de ellos es Vid Flumina, una corriente de 400 kilómetros de longitud que desemboca en el lago Ligeia Mare y que lleva el nombre de un río venenoso de la mitología nórdica. Este lago, por su parte, es mayor que el lago Superior, en América del Norte, y tiene una orilla de unos 2.000 kilómetros de largo.

A lo largo de miles de millones de años, la Tierra ha cambiado su piel. Los continentes se han movido sobre las placas tectónicas. La mayoría de las rocas más antiguas y de los fósiles de formas de vida más primitivas han desaparecido en el subsuelo, y continentes enteros se han sumergido. Han nacido islas y montañas, y los ríos han ido cambiando su curso.
Pero en Marte, cuya vida se congeló hace miles de millones de años, la historia ha sido diferente. La quietud de la superficie ha dejado a la vista el perfil de antiguos cráteres. Aunque su atmósfera desapareció, el cauce de los ríos permanece casi intacto desde entonces.

Los autores pueden usar estos análisis del curso de los ríos para distinguir si algunas regiones de los planetas están sufriendo más deformaciones que otras. Además, sugieren que también permitirían estudiar canales de lava en Venus y posibles restos de redes fluviales presentes en Plutón.
Cuando en septiembre la sonda Cassini desaparezca en el planeta Saturno, los científicos se quedarán sin ojos en el gigante gaseoso y sus increíbles lunas. Dos de ellas, Encélado y Titán, son dos objetivos de alta prioridad para la búsqueda de vida extraterrestre. Conocer todo lo posible sobre su superficie y su historia será fundamental para entender los grandes cuentos de la vida y del Sistema Solar. Para ello, no solo es crucial estudiar los paisajes, sino también las huellas dejadas por los ríos.
















 Totales: 69.198.535
Totales: 69.198.535 Conectados: 42
Conectados: 42


























