La radiactividad de algunos materiales




Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del “tubo Crookes”) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.


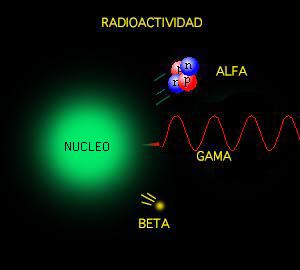
E. Rutherford odentificó los tres tipos principales de radiactividad: rayos Alfa, rayos Beta y Rayos Gamma
Por entonces, Rutherford, a su vez, separó del torio un “torio X” muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.

Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).




En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radiotorio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos, y así sucesivamente.

En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radiotorio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.


Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1921 se le concedió el premio Nóbel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.
¡Maravilloso!
Lo de maravilloso de antes, es que me entusiasmo con los movimientos que lleva a cabo la naturaleza para conseguir sus fines.


¿Cómo se explica que cuando el torio se descompone en “radiotorio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)


El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radiotorio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radiotorio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:


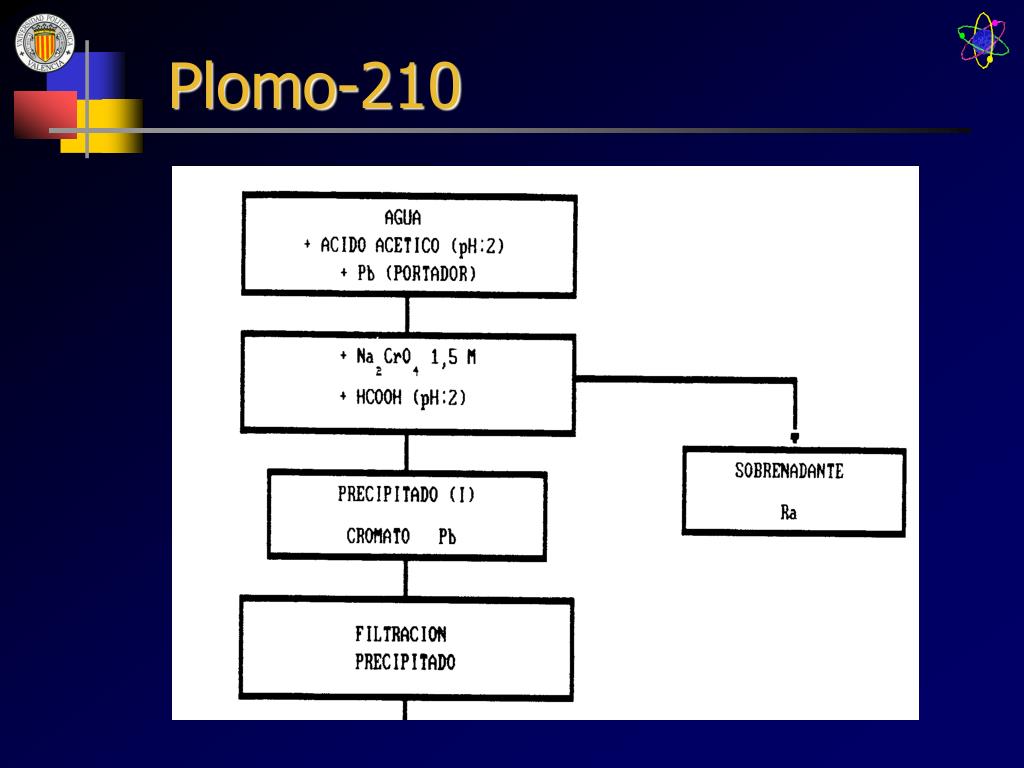
La variante radiactiva de este material tan atractivo se convierte en polonio-214 a los 20 minutos. El polonio-214 tan tarda sólo 160 milisegundos en convertirse en otro isótopo del plomo, el plomo-210, que tarda 22 años en descomponerse en bismuto-210, que a su vez tarda 5 días en convertirse en polonio-210 y, finalmente, después de 140 días, se transforma en plomo-206, el isótopo estable y no radiactivo que utilizábamos en el día a día hasta que nos dimos cuenta de lo tóxico que era.
La uranita (óxido de uranio) mineral del que se extrae el uranio y probablemente la única fuente natural de astato.
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”

“La Media Luna Fértil o Creciente Fértil es una región histórica que se corresponde con parte de los territorios del Levante mediterráneo, Mesopotamia y Persia. Se considera que fue el lugar donde se originó la revolución neolítica en Occidente.”
“El plomo se usó en la corte real de la Antigua China como estimulante, como moneda, y como anticonceptivo; la civilización del valle del Indo y los mesoamericanos lo usaron para hacer amuletos; y los pueblos de África oriental y meridional utilizaron plomo en el trefilado.”



Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.

Mediante un dispositivo inventado por cierto ayudante de J.J.Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituído por dos variedades de átomos: una cuyo número de masa era 20, y otra, 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo por cada diez. (Mas tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.)

Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban, el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas –el peso atómico- era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la “proporción” de cuatro a uno. En 1.922 se le otorgó el premio Nóbel de Química.


En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección. Demostró que, si bien 993 de cada 1.000 átomos de uranio grande uranio 238 (no válido para combustible nuclear), los siete restantes eran uranio 235 (buen combustible nuclear). Y, muy pronto se haría evidente el profundo significado de tal descubrimiento.
Así, después de esta siguiendo huellas falsas durante un siglo, se reivindicó definitivamente la teoría de Prout. Los elementes estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.

En la Tierra, del Uranio existente, sólo el 7 por 1.000 es Uranio acto como combustible nuclear de fisión, es decir, es el Uranio 235. ya que, la mayor parte del Uranio que existe, es el Uranio 238

que es como la madera mojada que no arde, tampoco es válido como combustible nuclear. El Hombre ideó que en un Reactor Generador, se podía bombardear el Uranio 238 con neutrones lentos de uranio 235. El resultado;


El Plutonio 239 si es utilizable como combustible nuclear de fisión
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
emilio silvera















 Totales: 67.036.108
Totales: 67.036.108 Conectados: 46
Conectados: 46 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en
Clasificado en 

































