Ago
2
El Carbono (El elemento de la Vida)
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Tanto es así, que existe un grupo de elementos denominado CHONPS o bioelementos que es considerado el más importante e indispensable para los se- res vivos. Como sus siglas indican, se trata del carbono (C), el hidrógeno (H), el oxígeno (O), el nitrógeno (N), el fósforo (P) y el azufre (S).
Ago
2
¡Todas las cosas son! El sabio elevó a todas las cosas a la categoría...
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)

Muchas veces miramos sin ver. Si nos paráramos a pensar en lo que nos quieren decir y que está presente en todas las cosas que podamos observar… ¡Nos asombrarían con los mensajes que nos están gritando! Nada es tan sencillo como parece y todo, sin excepción, está lleno de mensajes que la mayoría de las veces pasamos por alto debido a la inmensa ignorancia que, en realidad, es la mayor carga de la Humanidad. Si supiéramos comprender…
¡Conoceríamos mejor el mundo! Las cosas nos hablan del pasado, nos enseñan el presente y nos dicen cómo serán en el futuro.
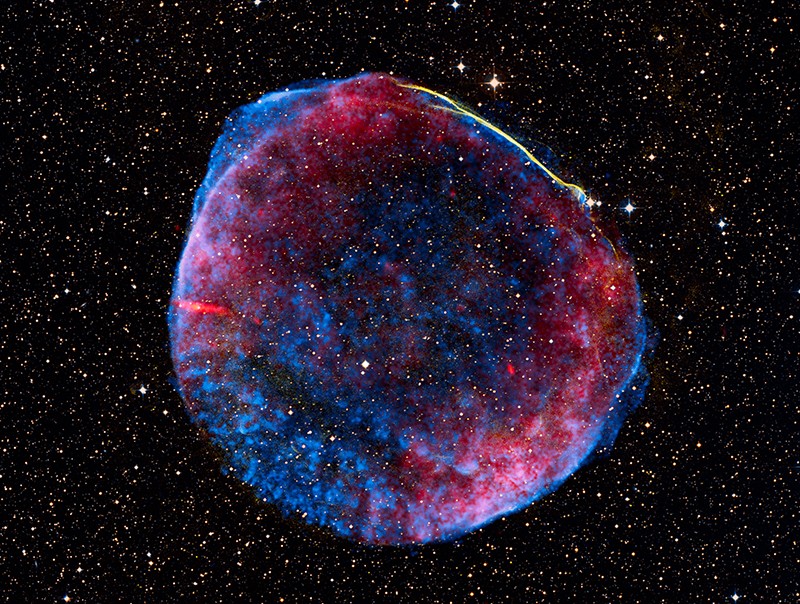
“Una nueva estrella, probablemente la supernova más brillante en toda la historia humana escrita, iluminó los cielos de nuestro planeta en el año 1006 d.C.
La nube de desechos en expansión de dicha explosión estelar, que se encuentra en la meridional constelación del Lobo, todavía nos deleita con un espectáculo de luces cósmicas a lo largo del espectro electromagnético.
De hecho, esta composición de imagenes incluye datos en rayos X en azul del Observatorio Chandra, datos ópticos en tonos amarillentos, e imagen de radio en rojo.
Ahora se le conoce como el remanente de supernova SN 1006, y su nube de desechos parece tener unos 60 años luz de diámetro. Parece que es lo que queda de una estrella enana blanca.
Como parte de un sistema estelar binario, la compacta enana blanca capturó gradualmente material de su estrella compañera.
Este aumento de masa finalmente desencadenó una explosión termonuclear que destruyó la estrella enana.
Como la distancia al remanente de supernova es de unos 7.000 añoz luz, esa explosión de hecho ocurrió 7.000 años antes de que su luz llegara a la Tierra en el 1006.
Las ondas en el remanente aceleran las partículas a energías extremas, y parecen ser la fuente de los misteriosos rayos cósmicos.”
Astronomy Picture of the Day




Las glaciaciones son cíclicas pero la razón no está del todo clara. “Una de las teorías la relaciona con los conocidos ciclos de Milankovitch, ciclos en la órbita de la Tierra y la orientación hacia el Sol que afectan la cantidad de energía que absorbe nuestro planeta”.Como lean esto los del “Cambio Climático”… ¡Me excomulgan!

James Lovelock es un científico independiente, meteorólogo, escritor, inventor, químico atmosférico, ambientalista, famoso por la Hipótesis Gaia, que visualiza a la Tierra como un sistema autorregulado.La hipótesis de Gaia: La Tierra no es una piedra, todos somos parte de un súper organismo

La Vida surgió en aquella Tierra primigenia de hace 3.800 millones de años


“Una entidad compleja que implica a la biosfera, atmósfera, océanos y tierra; constituyendo en su totalidad un sistema cibernético o retroalimentado que busca un entorno físico y químico óptimo para la vida en el planeta.”


“Hay más que evidencia de agua porque las sales están ahí. Además hemos encontrado los compuestos químicos necesarios para la vida como la conocemos. y, lo sorprendente de Marte es que no es un mundo extraño, sino que, en muchos aspectos es igual que la Tierra.”



La NASA confirma que en el pasado de Marte se produjeron miles de super erupciones volcánicas y existen túneles por los que corría la lava. Allí, en el subsuelo, la temperatura es mayor que en la superficie y, el agua, puede estar corriendo rumorosa, los líquenes, los hongos y las bacterias habrán proliferado en esos ambientes.
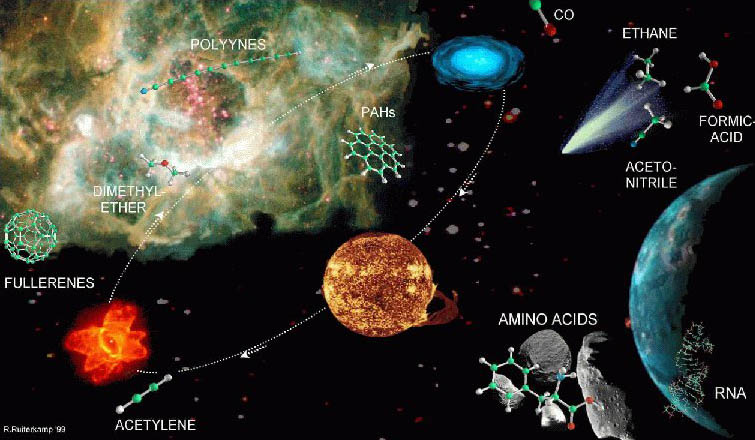


CHON es un acrónimo mnemotécnico de los cuatro elementos más comunes en los organismos vivos: carbono, hidrógeno, oxígeno y nitrógeno



De momento no se han encontrado pruebas que sugieran que exista o haya existido una biología basada en el silicio; ni tan siquiera de productos prebióticos de este elemento. Ni aquí, ni en meteoritos, cometas, el medio interestelar o las atmósferas de los planetas gigantes.






El milagro no es que aparezca vida fuera de la Tierra, el verdadero milagro sería… ¡Que no apareciera”.


Ago
1
¿Lo más importante? ¡Siempre será el Amor!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (4)
Comments (4)
Procuremos que el mundo mejore y que los comportamientos humanos lleguen a un nivel se consciencia que sea común para todos. Es decir, que podamos sentir el dolor ajeno como el propio dolor, que todos tengamos los mismos derechos, que nadie quede nunca marginado, que sea el Amor el verdadero motor que mueva el mundo y, cuando eso se consiga, entonces y sólo entonces, nos podremos llamar… ¡¡Humanos!!

Momentos inolvidables junto al ser Amado. No importa en qué lugar sucedió, aquella escena siempre estará en la Mente de los enamorados. El recuerdo feliz de aquellos primeros momentos
¿Qué se puede comparar con esos momentos vividos junto al Ser Amado? Nada causa más placer, nada tiene un efecto tan relajante, nada puede ser (aunque parezca contradictorio) tan excitante. Una simple mirada, una caricia, una sonrisa un mensaje en silencio. Todo eso y mucho más es el Amor que, sin limitación alguna perdura para siempre cuando hace honor a ese nombre y es verdadero.
y es verdadero.

Después de esos primeros momentos mágicos de la juventud enamorada, cuando el tiempo pasa, cuando la pareja se estabiliza y concluyen su primer recorrido creando un hogar para vivir juntos toda la vida. Cuando llegan esos hijos frutos de ese Amor sin fin, entonces, y sólo entonces, se verá qué clase de Amor es del que estamos hablando. En el Amor no todo se limita a las cosas bonitas y placenteras, está ese otro camino que tienen que recorrer los enamorados que es duro, muy duro y, mientras ese tiempo transcurre, comprenden mejor lo que sus padres les decían.
para vivir juntos toda la vida. Cuando llegan esos hijos frutos de ese Amor sin fin, entonces, y sólo entonces, se verá qué clase de Amor es del que estamos hablando. En el Amor no todo se limita a las cosas bonitas y placenteras, está ese otro camino que tienen que recorrer los enamorados que es duro, muy duro y, mientras ese tiempo transcurre, comprenden mejor lo que sus padres les decían.
:quality(75)/cloudfront-us-east-1.images.arcpublishing.com/elcomercio/I2ZOTPMEQ5BBJMRK7QSZ6CINKE.jpg)
En los malos momentos es cuando hay que estar
Una vez unidos, esos dos componentes desiguales del Amor (Hombre y Mujer) que forman la Unidad desde la desigualdad complementaria, comienzan el camino de la familia, y, tal recorrido, les lleva a sentir las mejores y más duras experiencias: Luchar por conseguirle a los hijos lo que ellos no tuvieron.
la desigualdad complementaria, comienzan el camino de la familia, y, tal recorrido, les lleva a sentir las mejores y más duras experiencias: Luchar por conseguirle a los hijos lo que ellos no tuvieron.

Claro que no todo es fiesta y jolgorio. Los momentos difíciles están ahí y, cuando el Amor hace honor a ese nombre , todo se puede sobrellevar y, al final, prevalece y resplandece la esencia que en él estaba encerrada, pasando todos los momentos malos y recuperando esa paz y ese sosiego que los enamorados necesitan para amarse. El enamorado piensa que sufrir, por algo que valga la pena, es una alegría. No, no es masoquista, es que se encuentra en un estado especial que le hace ver las cosas como realmente son y sabe dónde hay que sacrificarse.
, todo se puede sobrellevar y, al final, prevalece y resplandece la esencia que en él estaba encerrada, pasando todos los momentos malos y recuperando esa paz y ese sosiego que los enamorados necesitan para amarse. El enamorado piensa que sufrir, por algo que valga la pena, es una alegría. No, no es masoquista, es que se encuentra en un estado especial que le hace ver las cosas como realmente son y sabe dónde hay que sacrificarse.

No todos lo pueden lograr y, hacer el recorrido juntos hasta el final… ¡Ese es, el Amor verdadero! Sobran las palabras y, una simple mirada lo dice todo. Es la conjunción de dos Almas fusionadas en una
Después de muchos años juntos, de sobrellevarse el uno al otro, de conocerse hasta el punto de poder hablar sin palabras, una simple mirada se expresa de tal manera que, los sonidos de la voz, han dejado de ser necesarios. Ese punto del Amor, en este mundo de hoy, ¿Cuántos lo pueden conquistar? Lo cierto es que, para conseguirlo, el secreto está en el respeto mutuo, en hacer de cada día ese “día de especial”, que no sea un sólo día al año, sino que, durante los 365, le estemos regalando a la persona amada, toda clase de preciosos presentes en forma de un buen comportamiento, ayudándole en todo aquello que pueda necesitar y, sobre todo. Que nunca, en ninguna situación, la persona amada se sienta sola, siempre tiene que sentir que estamos junto a ella en todas las circunstancias para amarla y defender sus derechos como persona. ¡AH! Es importante dejarle su propio espacio y no agobiarla.
de un buen comportamiento, ayudándole en todo aquello que pueda necesitar y, sobre todo. Que nunca, en ninguna situación, la persona amada se sienta sola, siempre tiene que sentir que estamos junto a ella en todas las circunstancias para amarla y defender sus derechos como persona. ¡AH! Es importante dejarle su propio espacio y no agobiarla.

La mayor felicidad de una madre
La fuerza del Mundo, la energía del Universo, la misma que está en las estrellas del cielo, también, presente en nosotros, sale a la luz del mundo en la manera que la Naturaleza ha elegido para ello: La descendencia que nos muestra el fruto del Amor. Por ello luchamos y son ellos los que nos hacer seguir adelante en los momentos en los que, el desaliento pretende apoderarse de nosotros. Miramos lo que nos rodea y dándole un papirotazo a la desazón y al desaliento, volvemos a tomar energías renovadas que, no sabemos de dónde podrán venir pero… ¡Ahí están! El Amor es mucho Amor.
seguir adelante en los momentos en los que, el desaliento pretende apoderarse de nosotros. Miramos lo que nos rodea y dándole un papirotazo a la desazón y al desaliento, volvemos a tomar energías renovadas que, no sabemos de dónde podrán venir pero… ¡Ahí están! El Amor es mucho Amor.

Hablar del Amor y pretender aquí, en unas pocas palabras adornadas con imágenes, explicar lo que es el Amor, sería muy pretencioso, toda vez que, el Amor es más, mucho más que lo que yo os pueda decir en unas líneas surgidas de mis pensamientos de un momento. Sentirlo primero profundamente y explicarlos después, ha traído de cabeza a los mejores poetas y, desde luego yo, no soy uno de ellos.
¡El Consejo! Ser comprensible en todo momento y, sobre todo, ser generosos, dar más de lo que se espera recibir.
y, sobre todo, ser generosos, dar más de lo que se espera recibir.
¡Darlo todo sin pedir nada! Es una alegría
emilio silvera
Ago
1
Ya podemos “viajar” desde el núcleo atómico hasta las...
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Junto a las Constantes Universales rigen todo el Universo, lo que nos lleva a pensar que, no importa de qué región estemos hablando ni lo lejos que pueda estar, allí ocurren las mismas “cosas” que aquí.


El propio Rutherford empezó a vislumbrar la respuesta a la pregunta que arriba hacemos. Entre 1.906 y 1.908 (hace más de un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor
que arriba hacemos. Entre 1.906 y 1.908 (hace más de un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos.
parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos.
En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
por fuerza muchos millones de átomos al atravesar la lámina metálica.

Era lógico suponer , pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber
, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
En 1.908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
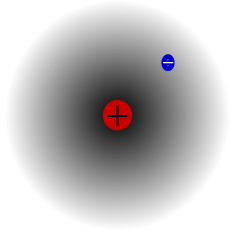
Átomo de hidrógeno, núcleo y electrón
Desde entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.

El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir
un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir , una partícula subatómica portadora de dos unidades de carga positiva.
, una partícula subatómica portadora de dos unidades de carga positiva.
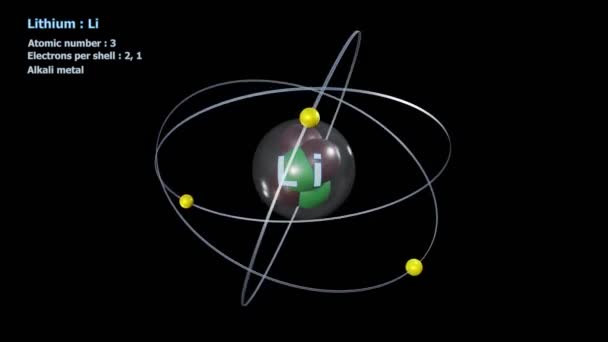
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de carga positiva en el núcleo atómico deben ser numéricamente idénticas a los electrones que contiene por norma, pues el átomo suele ser un cuerpo neutro, y esta igualdad de lo positivo con lo negativo es el equilibrio. De hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación
de electrones atómicos dentro de la formación iónica, pero en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.
iónica, pero en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.

Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.
de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía el núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. Como es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó esta idea general
y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. Como es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó esta idea general . Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.
. Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.
Pero entre tanto se habían presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto , si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿Cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por número
, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿Cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por número enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal , y ello dio lugar a una interesante historia.
, y ello dio lugar a una interesante historia.

Los tres isótopos naturales del carbono: carbono-12 (6 protones y 6 neutrones), carbono-13 (6 protones y 7 neutrones) y carbono-14 (6 protones y 8 neutrones). En los tres casos es carbono, tiene el aspecto de carbono y se comporta químicamente como carbono, por tener seis protones (y forma parte de nuestro organismo, por ejemplo). Sin embargo, sus propiedades físicas varían. Por ejemplo, mientras que el carbono-12 y el carbono-13 son estables, el carbono-14 es inestable y radioactivo: emite radiación beta, uno de sus neutrones “extras” se transforma así en un protón y el núcleo se convierte en nitrógeno-14 (que tiene 7 protones y 7 neutrones), con el aspecto y las propiedades del nitrógeno (por tener 7 protones). Dado que la mitad de la masa del carbono-14 pasa a ser nitrógeno-14 cada 5.730 años aproximadamente (más o menos lo que llevamos de civilización humana), la presencia de este isótopo natural resulta especialmente útil para la datación precisa de objetos históricos.
Isótopos; construcción de bloques uniformes

Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.
en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.

El Uranio 235 que es el único que de manera natural es apto para la fisión nuclear, es escaso, sólo el 7 por 1.000 es uranio 235, el resto , es uranio 238 que, no es combustible nuclear y, como la madera mojada, no arde. Sin embargo, si se bombardea con neutrones lentos del uranio 235, resulta que se convierte en Plutonio 239 que sí, es combustible nuclear válido. ¡Qué no idearemos para conseguir
, es uranio 238 que, no es combustible nuclear y, como la madera mojada, no arde. Sin embargo, si se bombardea con neutrones lentos del uranio 235, resulta que se convierte en Plutonio 239 que sí, es combustible nuclear válido. ¡Qué no idearemos para conseguir los objetivos!
los objetivos!
El Uranio es muy radiactivo y si está enriquecido… ¡Ya sabemos las consecuencias!
Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía
de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.
extraer de él repetidas veces uranio activo X. Para decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.
Por entonces, Rutherford, a su vez, separó del torio un torio X muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio , emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que durante la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.
, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que durante la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.
El Radón, uno de los llamados gases nobles, es incoloro, inodoro e insípido, además de –para nuestro mal- radioactivo. Suele presentarse según el tipo de suelos de determinadas zonas y con la descomposición de uranio, concentrándose en la superficie y siendo “arrastrado” en y por el aire que respiramos, y es en grandes cantidades es un gas perjudicial para la salud… y que anticipa terremotos.

Varios químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio
químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio A, radio
A, radio B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).
B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.
finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados. Entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907 los químicos americanos Herbert Newby McCoy y W. H. Ross descubrieron que el radiotorio (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio
de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio D, el mismo que el plomo, tanto que a veces era llamadoradioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.
D, el mismo que el plomo, tanto que a veces era llamadoradioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.
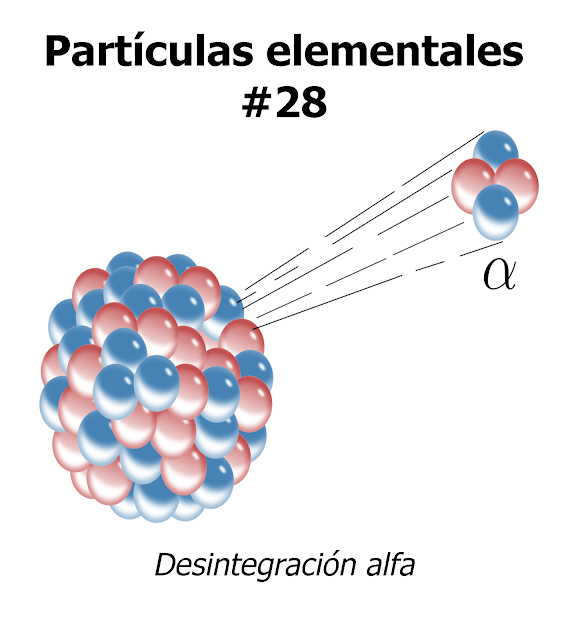
En 1.913, Soddy esclareció esta idea y le dio más amplitud. Demostró que cuando un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior . Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.
. Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.
Soddy dio el nombre deisótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
deisótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
El modelo protón–electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula alfa de un núcleo, se reducía en dos unidades la carga positiva de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!
atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!
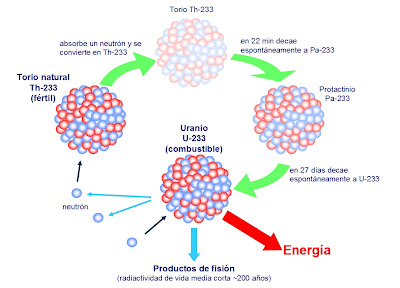
¿Cómo se explica que cuando el torio se descompone en radiotorio después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta, y más tarde una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro , aunque en cierto modo, esto no afecta al resultado).
, aunque en cierto modo, esto no afecta al resultado).
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía el número atómico 90, es decir, el mismo de antes.
atómico 90, es decir, el mismo de antes.
Así pues, el radiotorio, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de un átomo están sujetas al número de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).
de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o número másico. Así, el torio corriente se denomina torio 232, y el radiotorio, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones: plomo 210 (radio D), plomo 214 (radio B), plomo 212 (torio B) y plomo 211 (actinio B).
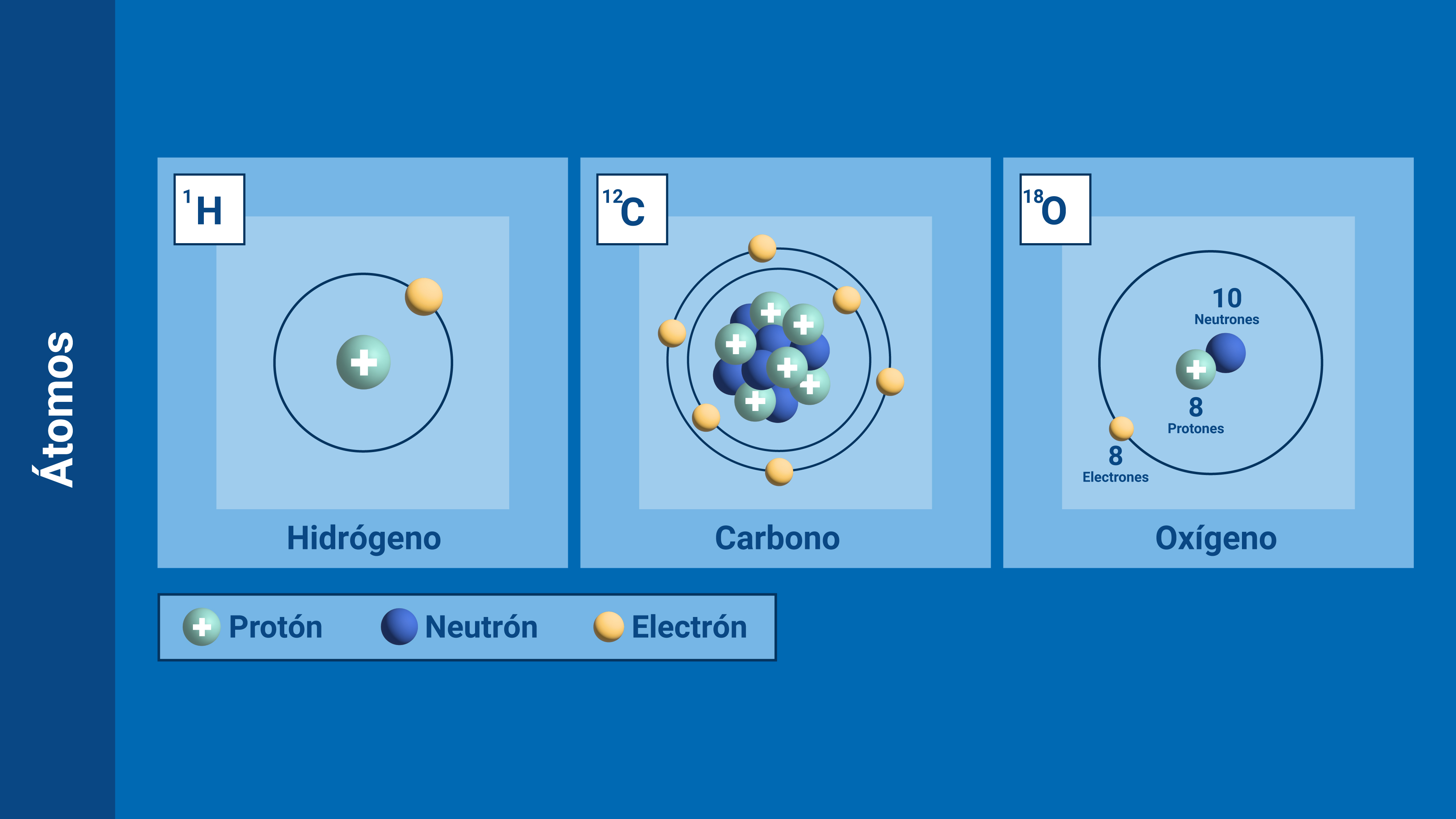

Se descubrió que la noción de isótopo podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206, la del torio en plomo 208 y la del actinio en plomo 207. cada uno de estos era un isótopo estable y corriente del plomo, pero los tres plomos diferían por su peso atómico.
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.
de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.
que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.

Sabiendo todo lo anteriormente explicado, hemos llegado a comprender cómo parte de la Astronomía que estudia las características físicas y químicas de los cuerpos celestes, la astrofísica es la parte más importante de la astronomía en la actualidad debido a que, al avanzar la física moderna: Efecto Doppler-Fizeau, el efecto Zeeman, las teorías cuánticas y las reacciones termonucleares aplicadas al estudio de los cuerpos celestes han permitido descubrir que el campo
de la astronomía en la actualidad debido a que, al avanzar la física moderna: Efecto Doppler-Fizeau, el efecto Zeeman, las teorías cuánticas y las reacciones termonucleares aplicadas al estudio de los cuerpos celestes han permitido descubrir que el campo magnético solar, el estudio de las radiaciones estelares y sus procesos de fusión nuclear, y determinar la velocidad radial de las estrellas, etc. La radiación electromagnética de los cuerpos celestes permite realizar análisis de los espectros que nos dicen de qué están hechas las estrellas y los demás cuerpos del espacio interestelar y, de esa manera, hemos ido conociendo la materia y sus secretos que cada vez, van siendo menos.
magnético solar, el estudio de las radiaciones estelares y sus procesos de fusión nuclear, y determinar la velocidad radial de las estrellas, etc. La radiación electromagnética de los cuerpos celestes permite realizar análisis de los espectros que nos dicen de qué están hechas las estrellas y los demás cuerpos del espacio interestelar y, de esa manera, hemos ido conociendo la materia y sus secretos que cada vez, van siendo menos.
emilio silvera
Fuentes variadas
Ago
1
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
















 Totales: 84.678.532
Totales: 84.678.532 Conectados: 72
Conectados: 72























