Jul
4
La palabra imposible…mejor dejarla aparcada
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Carnaval de Matematicas ~
Clasificado en Carnaval de Matematicas ~
 Comments (1)
Comments (1)
Auguste Comte (1798-1857)Filósofo francés, fundador del positivismo. Fue secretario y colaborador (1818-24) de Saint-Simon. … Basándose en esta tesis, Comte afirmaba que la “metafísica”, es decir, la teoría acerca de la esencia de los fenómenos, ha de ser eliminada. Tambien se atrevió (imprudente) a afirmar otras cuestiones que no estaban a su alcance asegurar.
En el siglo XIX algunos científicos declararon que la composición de las estrellas estaría siempre fuera del alcance del experimento. En 1825, el filósofo y crítico social francés Auguste Comte, al escribir el Curso de Filosofía, declaraba que nunca conoceríamos las estrellas de otra forma que como inalcanzables puntos de luz en el cielo debido a su enorme distancia de nosotros. Las máquinas del siglo XIX, o de cualquier siglo, argumentaba, no eran suficientemente potentes como para escapar de la Tierra y alcanzar las estrellas.
Sin embargo, las líneas espectrales de Franhoufer nos dijo de manera clara y precisa de que estaban hechas las estrellas y otros objetos celestes.
Así que parecía que el determinar la composición de las estrellas era imposible, y lo curioso es que casi al mismo tiempo, el físico alemán Joseph von Fraunhofer estuviera haciendo precisamente eso. Utilizando un prisma y un espectroscópio pudo descomponer la luz blanca emitida desde las estrellas lejanas y determinar la composición química de dichas estrellas. De la misma manera pudiera, en este mismo instante, estar trabajando un físico-matemático en profundizar en la teoría de supercuerdas y estar formulando otro respetable avance hacia nuestro futuro

¿Qué sería de nosotros sin la física?
Tampoco los átomos eran verificables hace dos siglos y llegaron Mach, Planck, Einstein, Heisenberg, Schrödinger, Feymann, Gell- Mann y tantos otros que dejaron todo el misterio al descubierto con la mecánica cuántica que nos puede facilitar datos con una precisión asombrosa.
Por eso, no puedo dejar de tener esperanzas sobre esperar la confirmación experimental de la física de la décima dimensión por métodos directos; la llave: nuestra imaginación.
Otra idea difícil de verificar en física fue la existencia de los evasivos neutrinos. Hace poco tiempo, hablando con el doctor de física teórica e ingeniero de materiales, además de astrofísico, Alcione Mora, me contó que entraba a formar parte de un grupo o equipo que iniciarán el proyecto de diseñar y construir los aparatos tecnológicos necesarios para, posteriormente, en las profundidades de la Antártida, buscar neutrinos.
Jul
4
¿La materia? No es fácil llegar a entenderla
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Astronomía y Astrofísica ~
Clasificado en Astronomía y Astrofísica ~
 Comments (2)
Comments (2)
Un átomo simple de un mismo elemento constituye, a su vez, una molécula simple del propio elemento. El oxígeno (O), hidrógeno (H), cloro (Cl), sodio (Na), cobre (Cu), hierro (Fe), plata (Ag) y el oro (Au), por ejemplo, son átomos de elementos simples y constituyen, al mismo tiempo, moléculas de cada uno de esos mismos elementos..
 Átomo de cloro (Cl), cuyo número atómico es 17, de acuerdo con la suma total de electrones que posee. en sus tres órbitas (2 + 8 + 7 = 17) y átomo de sodio (Na), de número atómico 11, de acuerdo también. con la suma de la cantidad de electrones que posee (2 + 8 + 1 = 11). Como se puede apreciar, el cloro. posee 7 electrones en su última órbita, por lo cual es más propenso a captar el electrón que le falta para. completar ocho, mientras que el sodio, al tener sólo 1 electrón, es más propenso a cederlo.
Átomo de cloro (Cl), cuyo número atómico es 17, de acuerdo con la suma total de electrones que posee. en sus tres órbitas (2 + 8 + 7 = 17) y átomo de sodio (Na), de número atómico 11, de acuerdo también. con la suma de la cantidad de electrones que posee (2 + 8 + 1 = 11). Como se puede apreciar, el cloro. posee 7 electrones en su última órbita, por lo cual es más propenso a captar el electrón que le falta para. completar ocho, mientras que el sodio, al tener sólo 1 electrón, es más propenso a cederlo.
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro.
El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
Fuerzas de van der Waals
Las moléculas de agua están formadas por un átomo de oxígeno y dos de hidrógeno separados 104,45° entre sí (H2O). Estas moléculas se unen a su vez mediante un enlace llamado “por puente de hidrógeno”, formando una red molecular más compleja.
Jul
4
El nucleo atomico
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Sin categoría ~
Clasificado en Sin categoría ~
 Comments (2)
Comments (2)
El núcleo atómico
Rutherford descubrió que el átomo tenía un núcleo más denso. Entre 1906 y 1908 (hace ahora más de un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado.
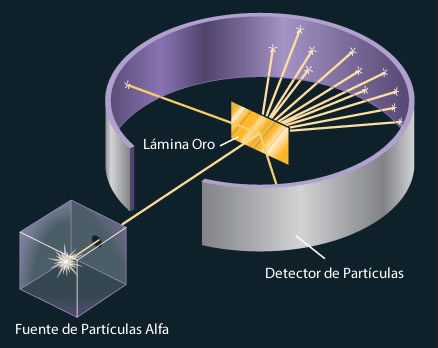
Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).

En 1908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
Jul
3
Completar el Modelo estándar
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comments (0)
Comments (0)
No está completo el llamado Modelo Estándar que describe las partículas que forman la materia conocida y las fuerzas que intervienen e interaccionan con ellas. La gravedad, quedó plasmada en la relatividad general de Einstein.
¿Por qué es incompleto el modelo estándar? Una carencia es que no se haya visto todavía el quark top. Otra la ausencia de una de las cuatro fuerzas fundamentales, la Gravedad. Otro defecto estético es que no es lo bastante simple; debería parecerse más a la tierra, aire, fuego y agua, de Empédocles. Hay demasiados parámetros y demasiados controles que ajustar.
Materia
Leptones levógiros Leptones dextrógiros
Antimateria
“Sin embargo, se verificó experimentalmente que la interacción nuclear débil viola la simetría P: se comporta diferente a su imagen especular. Esto supuso que otra simetría es violada para restaurar la simetría CPT. De esta manera la simetría CP y la simetría T se supusieron fundamentales. Experimentos sobre el kaón demostraron que el sector cuark viola la simetría CP, consecuentemente la simetría T, aunque esta última no pudo ser verificada experimentalmente debido a su dificultad.”
Necesitamos una nueva teoría que sea menos complicada, más sencilla y bella, sin vericuetos intrincados que salvar, con la limpieza y serena majestad de la teoría de la Gravedad que, con enorme simpleza y aplicando principios naturales, trata los temas más profundos del Universo.
Esperemos que continué desarrollándose la teoría de cuerdas y que, como parece, incluya todas las fuerzas, todas las partículas y, en fin, todos los parámetros que dan sentido al Universo.
A todo esto y como he dicho, el quark top está perdido y el neutrino tau, no se ha detectado directamente, y muchos de los números que nos hacen falta conocer los tenemos de forma imprecisa. Por ejemplo, no sabemos si los neutrinos tienen alguna masa en reposo.
Jul
3
La física de partículas y las interacciones fundamentales
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comments (1)
Comments (1)
El hombre se ha preguntado durante largo tiempo, “¿de qué está hecho el mundo?” Demócrito de Abdera nos hablaba del “átomo” y Empédocles de “elemenmtos”, otros, se referían a la sustancia cósmica a la que llamaban Ylem, aquella “semilla” primera que daría lugar a la venida de la materia. ¿No será el Ylem, lo que hoy llaman materia oscura?
Ahora sabemos que, no sólo nuestro mundo, sino todo el inmenso Universo, está hecho de pequeños objetos infinitesimales a las que hemos denominado partículas sub-atómicas y que forman varias familias. Unas son más elementales que otras y según, a qué familia pertenezcan, atienden o se rigen por una u otra fuerza elemental.
“Esquema de principios de siglo XX para un átomo de helio, mostrando dos protones (en rojo), dos neutrones (en verde) y dos electrones.”

Son los constituyentes fundamentales de toda la materia del Universo (por lo menos de toda la materia conocida y que podemos detectar formando estrellas y mundos, galaxias o seres vivos). Hemos podido llegar a saber que, de esas briznas de materia se forman los núcleos que, rodeados de electrones conforman los átomos de la materia.

Los grupos de átomos conforman las moléculas que son las unidades fundamentales de los compuestos químicos pero, comencemos por los núcleos atómicos:

Muchas son las veces que aquí mismo he podido explicar, que los quarks u y d se hallan en el interior de los nucleones y, por tanto, su habitat está en los núcleos atómicos donde se encuentran confinados y, en realidad, no intervienen directamente en las propiedades de los núcleos. Sin embargo, no podemos olvidar que la fuerza nuclear fuerte está ahí reteniendo a los Quarks por medio de losGgluones y, eso hace que, el núcleo sea estable.
Los núcleos atómicos constituyen un tipo de materia que, aisladamente, de forma individual (si exceptuamos el protón), siempre están en ambientes muy energéticos, por ejemplo, en el interior de las estrellas. En nuestro entorno terráqueo, es raro encontrar núcleos aislados, sino parcial o totalmente confinados dentro de los átomos.
Sabemos que el número de especímenes atómicos es limitado, existiendo ciertas razones para suponer que hacia el número atómico 173 los correspondientes núcleos serían inestables, no por razones intrínsecas de inestabilidad “radiactiva” nuclear, sino por razones relativistas. Ya señalé en otros escritos que, el número de especies atómicas, naturales y artificiales, es de unos pocos miles, en cambio, el número de moléculas conocidas hasta ahora comprenden unos pocos millones de especímenes, aumentando continuamente el número de ellas gracias a la síntesis que se lleva a cabo en numerosos laboratorios repartidos por todo el mundo.
Una molécula es una estructura, con individualidad propia, constituida por un conjunto de núcleos y sus electrones. La molécula más sencilla es la de Hidrógeno que tiene dos electrones, hasta las más complejas como las de las proteínas, con muchos miles de ellos, existen toda una gama de varios millones. Esta extraordinaria variedad de especies moleculares contrasta con la de las especies nucleares e incluso atómicas.
Molécula de Agua
Silicio
Desde el punto de vista de la información, las especies moleculares la poseen en mucho mayor grado que las nucleares o atómicas. Dejando aparte los núcleos, la información que soportan los átomos se podría atribuir a la distribución de su carga eléctrica, y en particular a los electrones más débilmente ligados. Concretando un poco más, se podría admitir que la citada información la aportan los orbitales atómicos, pues son precisamente estos orbitales los que introducen diferencias “geométricas” entre los diferentes electrones “corticales”.
Las partículas forman átomos, los átomos moléculas y las moléculas sustancias y cuerpos que están hechos por la diversa variedad de elementos que conforma la materia conocida y que, en definitiva, sólo son Quarks y Leptones-

“Durante el paso del tiempo una de las mayores incógnitas de la humanidad es saber de qué estamos hechos. Muchas filosofías antiguas creían eran un conjunto de elementos como el agua, el aire, el fuego y la tierra por mencionar algunos. Hoy en día los físicos creen que estamos formados por doce partículas fundamentales los quarks y leptones.”
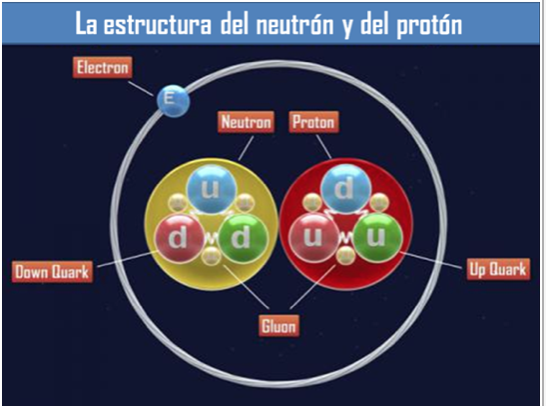
Con los Quarks formados en tripletes se forman los protones y neutrones que son los nucleones situados en el núcleo de los átomos (Hadrones de la rama barionica), otros hadrones llamados mesones están hechos de un Quarks y un antiquark y sus funciones son otras.
Los quarks y leptones como partículas fundamentales (se cree) no tienen infraestructura y no se puede descomponer en partículas más pequeñas. Estos interactúan a través de cuatro fuerzas para formar así el universo que lo conocemos hoy en día.
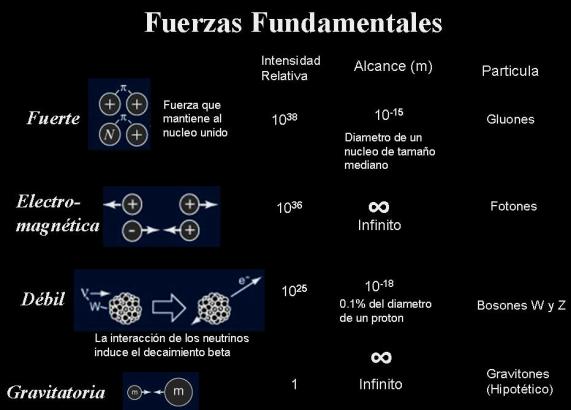
Partículas mediadoras de la fuerza nuclear débil

La primera imagen que se logró de la partícula de luz: El Fotón, la partícula mediadora de todas las interacciones electromagnéticas del Universo.
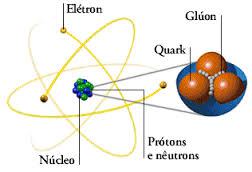
Los Quarks están confinados dentro de los nucleones (Protones y Neutrones= retenidos por la partícula mediadora llamada Gluón (en la segunda imagen se ve la muestra).

El esquivo Gravitón (si existe), no ha podido ser encontrado, se cree que al ser la Gravedad la más débil de las cuatro fuerzas fundamentales su partícula mediadora el Gravitón es de escala infinitesimal y difícil de detectar.
Estas doce partículas elementales a su vez están mediadas por los intercambios de otro tipo de partículas que pueden referirse como mediadores de fuerza, de estos se conocen cuatro tipos: el “gluón”, “fotón”, “gravitón” y “bosones débiles”. Aunque en realidad, el gravitón aún no ha sido confirmado experimentalmente , pero muchos físicos asumen que existe este mediador.
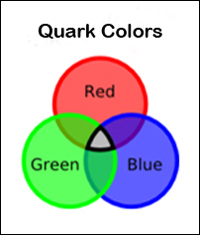
Como un núcleo y un electrón que se atraen entre sí debido a sus cargas eléctricas, los quarks se combinan entre sí por sus cargas de color . La fuerza que la mayoría de los físicos creen que los quarks son los bloques de construcción fundamentales que componen el universo, no se ha observado un quark aislado por sí mismo. Esto es debido a la naturaleza a fuerte es una fuerza que actúa entre cargas de color. Al igual que hay dos tipos de cargas eléctricas, hay tres tipos de cargas de color “rojo”, “azul” y “verde”, análogos a los colores primarios de la luz.
Ahora bien si conoces la teoría de los colores elementales de la luz , se puede recordar que la superposición de los tres colores elementales termina con el blanco. Esta es la razón por la cual un protón y un neutrón están formados por tres quarks. En un protón y un neutrón, un quark tiene un color rojo, otro tiene un color azul y la tercera uno tiene unie ha tenido éxito en aislar un quark, a este fenómeno se llama el confinamiento quark.
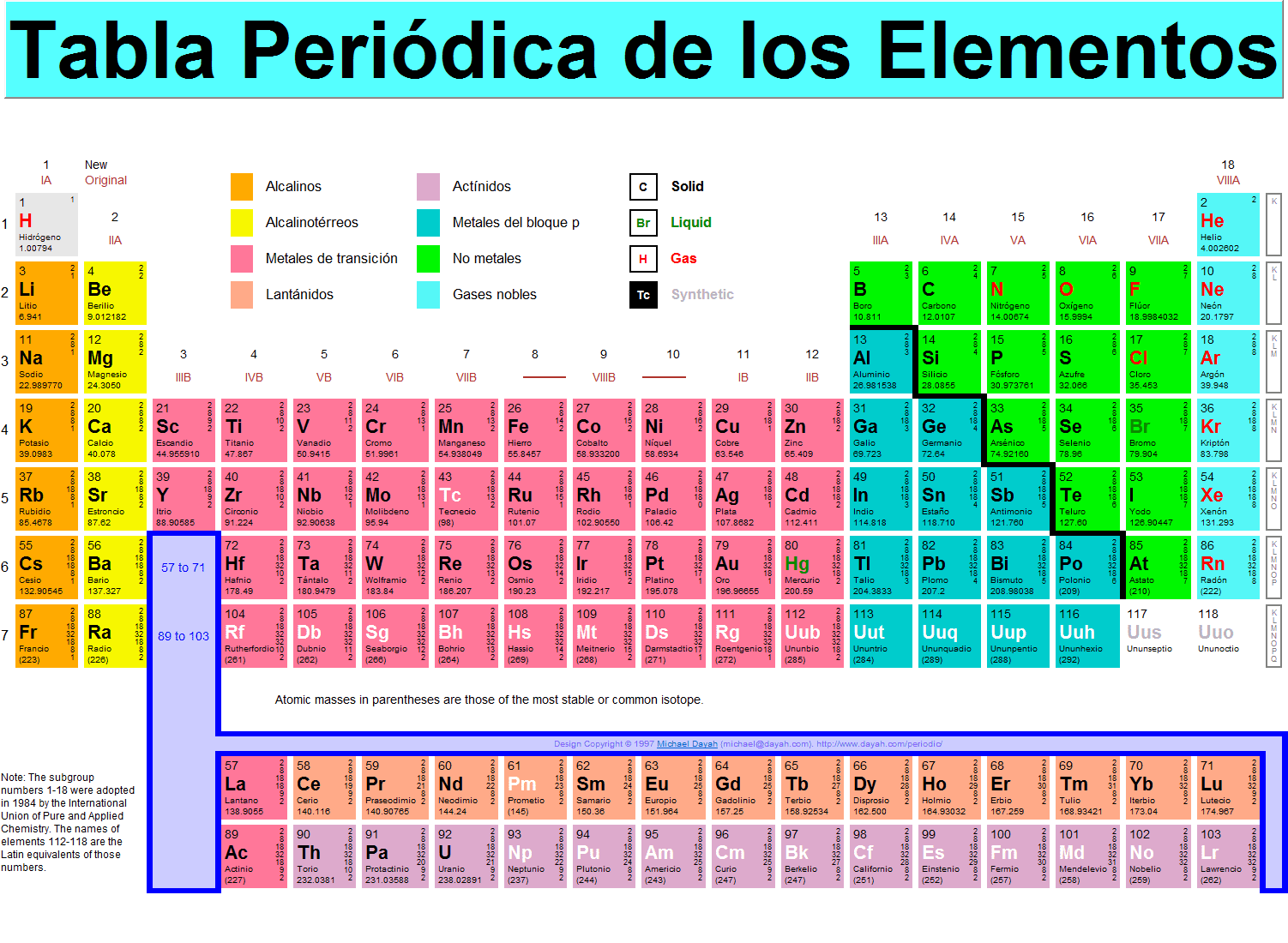
“La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones),2 por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Dmitri Mendeléyev publicó en 1869 la primera versión de tabla periódica que fue ampliamente reconocida. La desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas,7 si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.8 Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.”
“De los elementos con número atómico entre 1 hasta 92, todos a excepción de cuatro (43Tc, 61Pm, 85At, y 87Fr) se pueden detectar fácilmente en ciertas cantidades en la Tierra, teniendo una vida estable, o unos isótopos de vida media relativamente larga, o se generan como subproductos del uranio. Todos los elementos con gran número atómico tienen una probabilidad alta de haber sido generados de forma artificial, otros son extremadamente raros y por lo tanto han sido descubiertos mediante investigaciones científicas, y otros por el contrario no han existido anteriormente, como el plutonio y el neptunio, de los cuales ninguno tiene existencia natural sobre la tierra.
Todos ellos son radiactivos, con una vida media más corta que la edad de la Tierra, de esta forma es posible que estos elementos, estuvieran presentes en la formación de la tierra. Las trazas de neptunio y plutonio aparecen solo durante las pruebas de las bombas atómicas explotadas en la atmósfera. Tanto el Np como el Pu generados proceden de captura de neutrones en el uranio con dos reacciones posteriores de decaimiento beta.”
“La mayoría de los elementos generados de forma artificial se pueden obtener como elemento sintético vía reacciones nucleares o acelerador de partículas. La vida media de estos elementos suele decrecer con el número atómico.
“Algunos isótopos de los elementos níquel (Ni), cobre (Cu) y zinc (Zn). Como en la mayoría de las tablas de isótopos, los elementos se organizan de abajo hacia arriba según su número atómico creciente, y los isótopos de izquierda a derecha según su masa creciente. Color negro: isótopos estables; azul: isótopos emisores de partículas beta; rojo: isótopos emisores de partículas beta.”
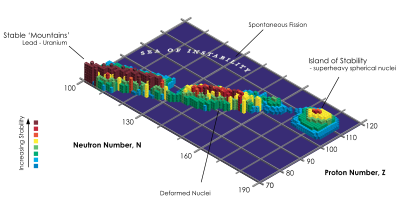
Existen, no obstante excepciones, que incluyen el dubnio y algunos isótopos del curio. El químico Glenn T. Seaborg (Premio Nobel de Química) llegó a crear leyes empíricas capaces de predecir estas anomalías. Todas ellas se categorizan en lo que viene a denominarse como “isla de estabilidad”. Los elementos transuránicos no descubiertos todavía, o que no han sido denominados de forma oficial, emplearán la nomenclatura indicada por la IUPAC. A pesar de ello la denominación de algunos elementos transuránicos en el pasado y hoy en día son fuentes de controversia.·
Lista de los elementos transuránicos
- 93 neptunio Np
- 94 plutonio Pu
- 95 americio Am
- 96 curio Cm
- 97 berkelio Bk
- 98 californio Cf
- 99 einstenio Es
- 100 fermio Fm
- 101 mendelevio Md
- 102 nobelio No
- 103 lawrencio Lr
- elementos transactínidos
- 104 rutherfordio Rf
- 105 dubnio Db
- 106 seaborgio Sg
- 107 bohrio Bh
- 108 hassio Hs
- 109 meitnerio Mt
- 110 darmstadtio Ds
- 111 roentgenio Rg
- 112 copernicio Cn
- 113 nihonio Nh
- 114 flerovio Fl
- 115 moscovio Mc
- 116 livermorio Lv
- 117 teneso Ts
- 118 oganesón Og
- Podemos finalizar para decir que, la materia, esconde muchos secretos que aún, debemos desvelar.
Emilio silvera















 Totales: 85.991.868
Totales: 85.991.868 Conectados: 49
Conectados: 49