Sep
16
La Astronomía en el Islam… ¡A cada cual, lo suyo!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Queriendo saber ~
Clasificado en Queriendo saber ~
 Comments (0)
Comments (0)
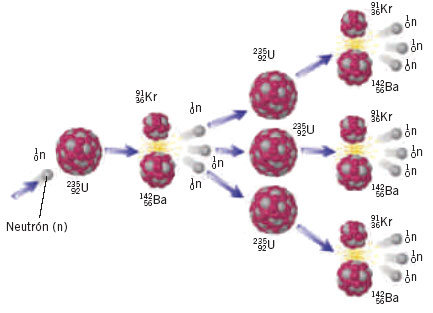
Poco después de la muerte del profeta Mahoma en el año 632, los musulmanes establecieron una especie de commanwealth o comunidad de naciones desde España hasta Asia Central. Llevaron a todas las tierras conquistadas una astronomía popular árabe que era una mezcla de la hindú, persa y griega que se unificaba con la local de cada lugar de conquista, y, hasta el siglo X no adquirió las características distintivas propias. A partir de entonces y hasta el siglo XV los expertos musulmanes fueron inigualables en sus conocimientos de astronomía que, en sus fundamentos más profundos estaba presente el legado de la antigua Mesopotamia.

Masjid al-Nabawi en Medina. En esta mezquita se encuentra la tumba de Mahoma y de los dos primeros califas, Abu Bakr y Umar ibn al-Jattab.
En sus formas más tardías los zijs llegaron a ser unos documentos formados por varios cientos de páginas de textos y tablas. Algunos aspectos de la astronomía matemática que se podía encontrar en un zij típico incluían: trigonometría; astronomía esférica; ecuaciones solares, lunares y planetarias; latitudes lunares y planetarias; posiciones planetarias; paralajes; visibilidad solar y planetaria; geografía matemática (lista de ciudades con sus coordenadas geográficas correspondientes) con lo que se determina la dirección de la Meca; uranometría (tablas de estrellas fijas con sus coordenadas), y, no en menor proporción, astrología matemática.
La lista de astrónomos del Islam sería interminable.
“Abu al-Hasan ‘Ali ibn ‘Abd al-Rahman ibn Ahmad ibn Yunus al-Sadafi al-Misri (en árabe: ابن يونس ) (c. 950-1009) fue un importante matemático y astrónomo musulmán egipcio,1 2 3 4 cuyas obras destacaron por estar adelantadas a su tiempo, habiendo sido hechas en base a cálculos meticulosos y atención al detalle.

El cráter Ibn Yunus en la Luna lleva su nombre.”
En uno de estos zij, el famoso astrónomo egipcio Ibn Yunus describe cuarenta conjunciones planetarias y treinta eclipses lunares. Aplicando lo que sabemos actualmente sobre las posiciones de los planetas, se llega a la conclusión de que los resultados de Yunus son absolutamente correctos.
Aunque la religión no fue la única fuerza impulsora que espoleó el crecimiento de la astronomía en el mundo islámico -el hecho de ser una sociedad tolerante, multirracial y de una gran erudición, con una lengua predominante, el árabe, también fomentó este crecimiento-, las cuestiones sacras desempeñaron asimismo un importante papel.

El Islam necesitaba resolver de algún modo el problema de orientar exactamente hacia La Meca todas sus estructuras sagradas, así como a las personas que realizaban los cultos diarios. La cartografía de los cielos surgió de esta necesidad de fijar las coordenadas de los lugares santos y la dirección correcta, o gibla, de la orientación hacia la Cava, el altar de La Meca hacia el cual se vuelven los musulmanes cinco veces al día para rezar sus oraciones.
Pero ¿hacia donde está La Meca? Probablemente en los primeros tiempos las autoridades religiosas determinaron la gibla observando ciertos cuerpos celestes, tales como la estrella de Belén, que estaban en la dirección que en general tomaban los peregrinos cuando caminaban hacia La Meca. La propia Cava está alineada con unas direcciones específicas; su eje principal (meridional) se sitúa hacia el punto por donde sale la estrella Canope; su eje secundario, el de las fachadas este u oeste. Se alinea con el punto por donde el Sol sale el solsticio de verano y se pone en el solsticio de invierno. Un experto situado en un altar distante tenía que idear algún procedimiento para orientarse hacia el segmento de la Cava correspondiente a su ubicación, como si realmente se encontrara frente a ese segmento del perímetro de la Cava.

Las esferas armilares se pueden dividir en dos categorías, unas usadas para la observación como las utilizadas por Hiparco, Eratóstenes, Ptolomeo, Tycho Brahe y los árabes, donde cada uno de ellos fue perfeccionando el instrumento; y la otra como instrumento de demostración, para mostrar los principales elementos de la astronomía y geometría esférica. Las esferas usadas para la observación eran más grandes y poseían menos anillos que aquellas que servían como instrumentos de demostración, lo cual las hacía más precisas y fáciles de usar. Algunas de ellas incluían visores para orientar el instrumento apropiadamente y generar mayor precisión en la observación, de tal manera que, una vez dirigida hacia una estrella, se podían leer sus coordenadas celestes sobre sus escalas graduadas.

En 1957, dos brillantes historiadores se reunieron para estudiar un manuscrito astronómico de un autor árabe del siglo XIV. El documento, cuyo contenido parecía increíble, era desconocido para la mayoría de los historiadores de la ciencia. Lo había escrito Ibn al-Shatir, muwaqqit de la mezquita Umayyad central de Damasco. El texto redactado por el encargado del cómputo del tiempo, así debe entenderse el oficio de al-Shatir, adelantaba ideas de la teoría de Copérnico. Y ello, más de cien años antes del nacimiento del astrónomo polaco.
La astronomía griega se transmitió hacia el Este a los sirios, indios y árabes después de la caida del Imperio Romano. Los astrónomos árabes recopilaron nuevos catálogos de estrellas en los siglos IX y X y desarrollaron tablas del movimiento planetario. El astrónomo árabe Azarquiel, máxima figura de la escuela astronómica de Toledo del siglo XI, fue el responsable de las Tablas toledanas, que influyeron notablemente en Europa.
Al llegar el siglo IX, los astrónomos ya utilizaban instrumentos de cálculo trigonométrico y de otros tipos para determinar la gibla a partir de coordenadas geográficas. El enigma se convirtió muy pronto en un problema de astronomía esférica que utilizaba el cenit de la localidad en cuestión. En el tratado de geografía matemática de al-Biruni, por ejemplo, el objetivo era determinar la gibla correspondiente a Ghazni, Afganistán.
En el siglo IX, el gran mecenas de la ciencia el califa abasí al-Mamun, reunió a varios astrónomos en Bagdad para crear la casa de la Sabiduría (Bait al-Hikmah). Allí los astrónomos llevaron a cabo observaciones del Sol y de la Luna, con el fin de determina la latitud y la longitud locales para fijar la gibla. Recopilaron algunos de los mejores resultados de un zij titulado “Lo Comprobado” (al-Mumtahan).

Al-Biruni desarrolló técnicas para medir la Tierra y las distancias sobre ella utilizando la triangulación. Descubrió que el radio de la Tierra era 6.339,6 Kilómetros, un valor que no se obtuvo en Occidente hasta el siglo XVI. Uno de sus zijs contiene una tabla que da las coordenadas de seiscientos lugares, casi todos conocidos por él directamente.
Sin embargo, no todas las mediciones fueron hechas por el propio Biruni, sino que algunas las tomó de una tabla similar realizada por al-Jwarizmi (Parece ser que al-Biruni se dio cuenta de que, por lo que respecta a los lugares medidos tanto por al-Jwarismi como por Tolomeo, los valores obtenidos por al-Jwarismi eran los más precisos. Este personaje realizó también mediciones sobre la velocidad de la luz y constató que ésta, era inmensa si la comparaba con la del sonido.
La fascinación árabe por los aparatos mecánicos fomentó el desarrollo de la primera colección importante de instrumentos astronómicos diseñados para conseguir datos precisos sobre el tiempo, así como sobre el movimiento y la posición de los cuerpos celestes.

Lo dejo aquí, ya que, hablar de la Astronomía del Islam requeriría todo un tratado y una lista interminable de personajes que, como Thabit ibn Qurrah que realizó observaciones en la fundación de al-Mamun en Bagdad y en el siglo XI Ibn Yunus dirigió un equipo de observadores en El Cairo. En un Observatorio palaciego de Ghazni, en Afganistán, al Biruni consiguió y suministró unos datos que formaron la base sobre la que se realizaron los zijs más importantes de la astronomía islámica.
Tycho Brahe siempre ha sido presentado ante los estudiantes occidentales como el maestro de la creación y utilización de instrumentos anteriores al telescopio. La realidad es que al-Mamun construyó en el año 829 un esplendido observatorio y lo equipó con un sextante de piedra cuyo radio media unos 17 metros y con un cuadrante de 6 metros de radio. Este cuadrante era mayor que el famoso instrumento construido por Tycho Brahe siete siglos más tarde. Los sextantes de Beg llegaban a tener un radio de hasta 55 metros y se decía que el margen de error de sus instrumentos era tan aceptable, o más, que el de los instrumentos de Tycho Brahe construido un siglo más tarde. La obra teórica de los árabes fue también superior. Tycho Brahe llegó a la conclusión de que la Tierra no hacía movimiento de rotación alguno, haciendo así que la astronomía retrocediera varios siglos.
Quiero finalizar aquí este pequeño comentario o resumen con un recuerdo. No siempre hemos sabido dar el mérito que tienen algunos de los personajes de la Historia, ni tampoco de los pueblos que poblaron la Tierra antes que nosotros.

Al Sur de la puerta de Almodóvar de Córdoba, se levanta la estátua de Averroes. Jurista, médico, filósofo. El gran Averroes fue la máxima autoridad judicial de la época,(siglo XII). Fue acusado por los fundamentalistas de poner la razón humana por encima de la ley divina. La mirada del viejo filósofo se pierde las callejas mientras escucha el murmullo del agua del estanque junto al que reposa.
Nada de eso es cierto. De hecho, los eruditos islámicos admiraron y preservaron las matemáticas y la ciencia griega y actuaron como el hilo conductor de la ciencia de muchas culturas no occidentales, además de construir un edifcio propio impresionante en el campo de las ciencias. Lo cierto es que, la ciencia occidental es lo que es porque se construyó acertadamente sobre las mejores ideas de los distintos pueblos, los mejores e incluso, los mejores aparatos procedentes de otras culturas. Por ejmplo, los babilonios desarrollaron el teorema de Pitágoras (la suma de los cuadrados de los dos lados perpendiculares de un triángulo rectángulo es igual al cuadrado de la hipotenusa) al menos mil quinientos años antes de que Pitágoras naciera.
emilio silvera
Jul
3
La necesidad agudiza la imaginación
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Queriendo saber ~
Clasificado en Queriendo saber ~
 Comments (1)
Comments (1)

La fuerza nuclear débil nos habla de materiales que, de manera natural, emiten radiación y se desintegran. Al pensar en la desintegración me ha traído a la memoria aquellos libros de Asimov que nos explicaba cuestiones de ciencia y nos decía existen materiales que se desintegran de manera natural y que son materiales fértiles, o que sin serlo, se pueden transformar en otros que sí lo son.
Al hablar de material fértil me estoy refiriendo a núclidos que pueden absorber neutrones formar material fisible. El uranio-238, por ejemplo, absorbe un neutrón formar uranio-239, que se desintegra en plutonio-239. Este es el de conversión que la imaginación del hombre que ocurra en un reactor reproductor.

Lo explicaré con más detalles: El Reactor Reproductor Rápido es un reactor de neutrones rápidos diseñado producir combustible generando más material fisible del que consume. El FBR es uno de los tipos posibles de reactores reproductores.
Veámos: El uranio-235 es un combustible práctico, es decir, los neutrones lentos son capaces de que el uranio-235 se fisione, o lo que es lo mismo, se rompan sus átomos en dos, produciendo neutrones lentos, que a su vez inducen otras fisiones atómicas. El uranio-233 y el plutonio-239 son combustibles nucleares prácticos por las mismas razones.
Desgraciadamente, el uranio-233 y el plutonio-239 no existen en natural sino en trazas mínimas, y el uranio-235, aunque existe en cantidades apreciables, no deja de ser raro. En cualquier muestra de uranio natural, sólo siete de mil átomos son de uranio-235, el resto es uranio-238.

Uranio
El uranio natural extraído de las minas contiene un 99´3 % de U-238 y apenas el 0´7 % de U-235.
El uranio-238, la variedad común de uranio, no es un combustible nuclear práctico. Así que, el uranio que más abunda en la naturaleza no sirve combustible nuclear. Podemos conseguir que se fisione, sólo con neutrones rápidos. Los átomos de uranio-238 que se rompen en dos, producen neutrones lentos, que no bastan producir o inducir nuevas fisiones. El uranio-238 cabría compararlo a la madera húmeda: es posible que arda, pero acabará por apagarse.

El uranio es un elemento químico metálico de color plateado-grisáceo de la serie de los actínidos, su símbolo químico es U y su número atómico es 92. Por ello posee 92 protones y 92 electrones, con una valencia de 6. Su núcleo contener entre 142 y 146 neutrones, sus isótopos más abundantes son el 238U que posee 146 neutrones y el 235U con 143 neutrones. El uranio tiene el mayor peso atómico de todos los elementos que se encuentran en la naturaleza. El uranio es aproximadamente un 70% más denso que el plomo, aunque menos denso que el oro o el wolframio. Es levemente radioactivo. Fue descubierto óxido en 1789 por M. H. Klaproth que lo llamó así en el honor del planeta Urano que acababa de ser descubierto en 1781.
Supongamos, sin embargo, que se separa el uranio-235 del uranio-238 ( más bien difícil) y que se utiliza aquel hacer funcionar un reactor nuclear. Los átomos de uranio-235 que forman el combustible del reactor se fisionan y esparcen miríadas de neutrones lentos en todas direcciones. Si el reactor está rodeado por una capa de uranio ordinario (que en su mayor es uranio-238), los neutrones que van a parar allí son absorbidos por el uranio-238 y, aunque no pueden hacer que el uranio-238 se fisione, sí pueden provocar otros cambios que finalmente, producirán plutonio-239. Separando plutonio-239 del uranio (tarea muy fácil), puede ser utilizado como combustible nuclear practico para la fisión.
De manera, el reactor nuclear genera combustible a partir de un material (uranio-238) que no lo es. Este es el motivo de que al reactor nuclear que hace posible la transformación se le llame “reactor generador”.
Un reactor generador bien diseñado puede producir más plutonio-239 que el uranio-234 consumido para ello. De este modo, las reservas totales de uranio de la Tierra (y no sólo las de uranio-235) se convierten en potenciales de combustible nuclear.

Torio
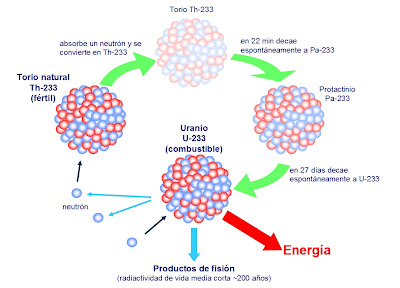
Carlo Rubbia, exdirector del CERN (los mismos que hicieron el Colisionador de Hadrones) y ganador del premio Nobel de física en 1984, ha trabajado buena de su carrera en el desarrollo de tecnologías la producción de energía a partir de torio y calcula que con un reactor adecuado, este proceso de fisión podría generar a partir de 1 tonelada del elemento la misma cantidad de energía que 200 toneladas de uranio y 3.500.000 toneladas de carbón.
El torio, tal se da en la naturaleza, consiste todo él en torio-232, que al igual que el uranio-238, no es un combustible nuclear práctico, porque requiere neutrones rápidos para fisionarse. Pero si se coloca torio-232 alrededor de un reactor nuclear, sus átomos absorberán los neutrones y, sin experimentar fisión alguna, se convertirán en átomos de uranio-233. el uranio-233 es un combustible práctico que se separar fácilmente del torio, el resultado es otra variedad del reactor generador, que convierte las reservas de torio en un combustible nuclear en potencia.


Hasta que no se descubra otra manera de producir energía, el Uranio seguirá
La cantidad total de uranio y de torio que hay en la Tierra es unas 800 veces mayor que las reservas de uranio-235, lo que significa que el buen uso de los reactores generadores podría multiplicar por 800 la oferta potencial de energía extraída de plantas de fisión nuclear.
En punto, sin dejar de elogiar la inteligencia del hombre que ha sabido encontrar la manera de transformar una materia inservible en otra practica, hay que decir que la energía de fisión nuclear genera también muchos problemas.
estará comprobando al lector de este , el autor ha querido vez diversificar los temas y plasmar una variedad múltiple que facilite el conocimiento de distintas cosas que ocurren en la naturaleza, o que la mano del hombre que ocurran, y todas estas cuestiones tratadas aquí van encaminadas a resolver preguntas que en alguna ocasión nos hemos podido , tales como:
¿Por qué al calentar un metal se pone primero rojo, luego naranja, después amarillo, a continuación blanco en lugar de seguir el espectro y ponerse verde?
¿Y el color en las estrellas?

un herrero está trabajando, el metal adquiere diferentes colores según recibe el calor de la fragua. Primero se mostrará de un rojo intenso, ir progresivamente adoptando tonos más claros, pasando del anaranjado al amarillo, y por fin al blanco.
Si se pudiera seguir calentando el hierro, éste adquiriría tonos azulados. Estos cambios en la coloración son una consecuencia directa del aumento de la temperatura, que permitirá mayor maleabilidad. El Cúmulo del Joyero (en la constelación de la Cruz del Sur), fotografiado arriba, muestra cómo ocurre lo mismo con las estrellas, de manera que encontraremos estrellas azules, las más calientes, blancas, amarillas, anaranjadas y rojas, las más “frías”. A veces, estos colores pueden percibirse a simple vista, Antares (Alpha Scorpii) que es de color rojo, o Rigel (Beta Orionis) blanco-azulada.
En la Naturaleza rigen las mismas leyes todos y, en todas partes se producen los mismos fenómenos debidos a las mismas causas, en caso: ¡La Temperatura!
Cualquier objeto, a cualquier energía superior al cero absoluto, radia ondas electromagnéticas. Si su temperatura es muy baja, emite sólo ondas de radio largas, muy pobres en energías. Al aumentar la temperatura, radia una cantidad mayor de ondas, empieza a radiar ondas de radio más cortas (y más energéticas). Si la temperatura sigue subiendo, empiezan a radiarse microondas aún más energéticas y después radiaciones infrarrojas.

Esto no quiere decir que a una temperatura dada sólo se emitan ondas de radio largas, un poco más arriba sólo ondas de radio cortas, luego sólo microondas y después sólo infrarrojos. En realidad, se emite toda la gama de radiaciones, pero siempre hay una radiación máxima, es decir, una gama de longitudes de onda que son las más radiadas, flanqueadas por cantidades menores en el lado de las energías bajas y por cantidades todavía más pequeñas en el de las altas.
un objeto alcanza la temperatura del cuerpo humano (37°C), el máximo de radiación se encuentra en los infrarrojos largos. El cuerpo humano radia ondas de radio, pero las longitudes de ondas más cortas y más energéticas son siempre las más fáciles de detectar por ser los más potentes.

la temperatura alcanza aproximadamente los 600°C, el máximo de radiación se halla en el infrarrojo corto. Pero a estas alturas la pequeña cantidad de radiación que se halla en el lado de las energías altas adquiere una importancia especial, porque entra ya en la región de la luz visible roja. El objeto reluce entonces con un rojo intenso.
rojo constituye sólo un pequeño porcentaje de la radiación total, pero da la casualidad de que nuestro ojo lo percibe, le otorgamos toda nuestra atención y decimos que el objeto está al “rojo vivo”.
Si la temperatura sigue subiendo, el máximo de radiación continúa desplazándose las longitudes de ondas cortas y vez se emite más luz visible de longitudes cada vez menores. Aunque el objeto radia más luz roja, se van agregando poco a poco luz anaranjada y luz amarilla en cantidades menores pero significativas. Al llegar a los 1.000°C la mezcla de colores la percibimos como naranja, y a los 2.000°C como amarilla. Lo cual no significa que a los 1.000°C sólo se radie luz naranja y a los 2.000°C sólo se radie luz amarilla, porque si fuese así, habría efectivamente que esperar que lo siguiente fuese “color verde”. Lo que en realidad vemos son mezclas de colores.

Al llegar a los 6.000°C (la temperatura superficial del Sol), el máximo de radiación está en el amarillo visible y lo que llega a nuestros ojos son grandes cantidades de luz visible, el violeta el rojo. La incidencia simultánea de toda la gama de luz visible sobre nuestra retina nos da la sensación de blanco, y de ahí el color del Sol.
Los objetos más calientes aún que el Sol radian todas las longitudes de ondas de luz visible y en cantidades todavía mayores, el máximo de radiación se desplaza al azul, de modo que la mezcla se desequilibra y el blanco adquiere un tinte azulado.
Toda travesía se produce para objetos calientes que emiten “espectros continuos”, es decir, que radian luz en la forma de una ancha banda de longitudes de ondas. Ciertas sustancias en adecuadas, radian sólo luz de determinadas longitudes de onda. El nitrato de bario radia luz verde se calienta, y con ese fin se lo utiliza en los fuegos de artificio, “calor verde”, podríamos decir.


Nitrato de Bario que produce el color verde en los bonitos fuegos artificiales
¡Qué bonito es saber!

En alguna ocasión todos hemos oído mencionar la palabra “gases nobles”, y sin embargo no siempre sabemos lo que son y el por qué le llaman así. Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan “inertes”. El nitrógeno y el platino son ejemplos de elementos inertes.
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química. Estos nuevos gases (helio, neón, argón, kripton, xenón y radón) son más inertes que cualquier otro elemento y se agrupan bajo el de gases inertes.
Los elementos inertes reciben a veces el calificativo de “nobles” porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia. El oro y el platino son ejemplos de “metales nobles”, y por la misma razón se llaman a veces “gases nobles” a los gases inertes. 1.962, el más común era el de gases inertes, quizá porque lo de nobles parecía poco apropiados en sociedades democráticas.

Es apropiado incluir una descripción de grupo de elementos conocido en un capítulo dedicado a los halógenos, porque el flúor es el único elemento conocido que entra en combinación química directa con los dos gases nobles más pesados, el xenón y el criptón, resultando en compuestos estables.
Los gases nobles surgen en la naturaleza constituyentes menos abundantes de la atmósfera. La primera indicación de la existencia de los gases nobles fue divulgada por el químico ingles Cavendish, en 1784.
La razón de que los gases inertes sean inertes es que el conjunto de electrones de uno de sus átomos está distribuido en capas especialmente estables. La más exterior, en concreto, tiene 8 electrones. Así la distribución electrónica del neón es (2,8) y la del argón (2,8,8). Como la adición o sustracción de electrones rompe distribución estable, no pueden producirse cambios electrónicos. Lo cual significa que no pueden producirse reacciones químicas y que estos elementos son inertes.
bien, el grado de inercia depende de la fuerza con que el núcleo, cargado positivamente y situado en el centro del átomo sujeta a los 8 electrones de la capa exterior. Cuantas más capas electrónicas haya la exterior y el centro, más débil será la atracción del núcleo central sobre los electrones de esa última capa de electrones.

El Radón es un gas radiactivo de origen natural procedente de la desintegración radiactiva de pequeñas cantidades de uranio presentes en rocas y suelo, es el responsable de miles de muertes por en Europa cada año. El gas se filtra en los edificios a través del suelo y de los sótanos, puede acumularse llegando a niveles elevados, especialmente en espacios cerrados y poco ventilados.
Quiere esto decir que el gas inerte más complejo es también el inerte. El gas inerte de estructura atómica más complicada es el radón. Sus átomos tienen una distribución electrónica de (2,8,18,32,18,8). El radón, sin embargo está sólo constituido por isótopos radiactivos y es un elemento con el que difícilmente se pueden experimentos químicos. El siguiente en orden de complejidad es el xenón, que es estable. Sus átomos tienen una distribución electrónica de (2,8,18,18,8).

Se sabe hace décadas que la abundancia en la Tierra del xenón es menor de lo que debería ser según las proporciones observadas del resto de gases nobles. Las abundancias de estos gases se usan por los geoquímicos para evaluar y datar los principales procesos terrestres, incluyendo la formación de la atmósfera. Para poder hacerlo parten de una hipótesis básica: que los gases nobles son inertes en toda circunstancia. Un realizado por Gary Schrobilgen y David Brock, de la Universidad McMaster (Canadá), cuyos resultados se publican en el Journal of the American Chemical Society explica la baja abundancia del xenón y pone en evidencia que el xenón no es tan noble se suponía.
Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos. En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente. El átomo con mayor apetencia de electrones es el flúor, y así fue en 1.962 el químico canadiense Neil Bartlett consiguió formar compuestos de xenón y flúor.
Desde entonces se han conseguido formar también compuestos de radón y kriptón. Por eso los químicos rehúyen el de gases inertes, porque a fin de cuentas, esos gases no son completamente inertes. Hoy día se ha impuesto la denominación de “gases nobles”, y existe toda una rama de la química que se ocupa de los “compuestos de gases nobles”.

Naturalmente, cuanto más pequeño es el átomo de un gas noble, más inerte es, y no se ha encontrado nada que sea capaz de arrancarles algún electrón. El argón, cuya distribución electrónica es de 2,8,8 y el neón, con 2,8 electrones respectivamente, sigue siendo completamente inerte. Y el más inerte de todos es el helio, cuyos átomos contienen una sola capa electrónica con dos electrones (que es lo máximo que alojar primera capa) que al estar en la primera linea cerca del núcleo positivo, están fuertemente atraídos al tener su carga eléctrica el signo negativo.
finalizar diré que los gases nobles (gases inertes, gases raros) están clasificados en el grupo 18 (antiguamente 0) de la Tabla periódica de los elementos y se definen por símbolos que responden a: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn).

Ya se dijo antes la configuración electrónica de uno de ellos y todas las capas internas están completamente ocupadas, lo que hace que estos elementos, por tanto, constituyan la terminación de un periodo y posean configuración de capa completa, por lo que sus energías de ionización son muy elevadas y su reactividad química escasa.
son monoatómicos, las moléculas de los gases nobles poseen simetría esférica, y las fuerzas intermoleculares son muy débiles, por lo que sus entalpías de vaporización son muy bajas.
Con todo lo anteriormente expuesto sobre los gases nobles, espero que el lector del aquí reflejado pueda tener una idea más amplia y un conocimiento más certero sobre lo que en realidad son los denominados como “gases nobles”.
En comparación con la inmensidad del universo, nos queda aún muchísimo que aprender. Si nos limitamos a nuestro entorno más cercano, la Tierra, ¿cómo hemos podido llegar tan lejos?
¡La curiosidad! y ¡La necesidad! ¡El Instinto! y ¡La Evolución! Todo ello, amigos míos, nos lleva a querer saber y, ello, debemos desvelar los secretos de la Naturaleza, que por cierto, no resulta nada fácil. Llevamos miles de años intentando comprender y, de momento, sólo sabemos… ¡Algunas cosas!
emilio silvera
Fuente: Variada y destacando, Cien preguntas básicas sobre ciencia de Asimov.
May
22
Estamos señalados por muchos dones pero…¡El habla!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Queriendo saber ~
Clasificado en Queriendo saber ~
 Comments (0)
Comments (0)

No solo pintaban en las paredes rocosas de sus grutas, sino que , de manera rústica emitían sonidos guturales que, más tarde fueron palabras que les llevó a entenderse entre ellos de manera natural para expresar sus pensamientos y hacer la convivencia más llevadera. El instinto siguió su desarrollo pero, las palabras vinieron a facilitar la vida en común y el entendimiento entre los iguales.
En tiempos, circuló una tesis por ahí que, en la actualidad es casi creacionista porque niega el proceso evolutivo. Dice que el lenguaje, en este caso concreto la palabra hablada, apareció de pronto entre los humanos hace entre 35.000 y 50.000 años, más o menos, como un big bang de la especiación. Según algunos, la capacidad de expresar la palabra y de utilizar sintaxis se implantó genéticamente en nuestros cerebros en relativamente reciente, en una especie de órgano del lenguaje. Esta concepción del lenguaje está relacionada con la antigua idea de que el pensamiento lógico o racional depende en cierto modo de las palabras. La idea procede de Platón y estuvo muy en boga en el siglo XIX entre algunos autores, como Jacob Grimm (“Los animales no hablan porque no piensan”) y Max Muller (“El lenguaje es nuestro Rubicón y ningún animal se atreverá cruzarlo”) y “Sin lenguaje no hay razón y sin razón no hay lenguaje”).

NO, no fue ninguna especie de big bang de la especiación. El habla, amigos míos, nos llegó en algún momento de nuestra evolución, no de repente ni por arte de magia, sino que, tras un largo período de entrenamiento se fueron modulando las palabras que finalmente conformaría un lenguaje entendible que dio lugar a la necesaria comunicación entre los seres humanos. Ninguna ráfaga luminosa nos llegó los cielos para dotarnos de ese preciado don que es el habla.
La idea creacionista del gran salto adelante en la calidad del pensamiento humano se refleja muy en una interpretación habitual del arte europeo del Paleolítico Superior…


Según este punto de vista, pinturas rupestres europeas y figurillas talladas con más de 30.000 años de antigüedad son barruntos del pensamiento simbólico y abstracto y también del lenguaje. Sin embargo, la madura perfección de las pinturas más antiguas de la cueva de Chauvet, en el sur de Francia, parece desmentior teoría. En cualuqier caso, esta interpretación eurocéntrica pasa por alto el hecho de que los australianos, en la otra punta del planeta, conocían la pintura rupestre en la misma época que los primeros europeos. Hay muchas pruebas y razones, suponer, que un común antepasado africano dominaba ya las técnicas del habla, la pintura y la representación simbólica mucho antes de que salieran de África, hace 80.000 años.

Otro problema de la teoría creacionista, o del “big bang”, sobre la unicidad de las facultades humanas modernas es que hay indicios de que los neandertales tenían ya la misma anatomía vocal especializada que nosotros y, es más, según todos los y estudios, el antepasado común de los neandertales y nuestro, el Homo heidelbergensis, hablaba ya hace medio millón de años. Así lo revelan las configuraciones anatómicas en fósiles profundamente estudiados.
La especulación anatómica nos devuelve qa los primeros humanos y a la espectacular aceleración del crecimiento encefálico experimentada por los géneros Homo y Paranthropus. Si alguna vez existió un “big bang” en la especiación de los homínidos inteligentes se debió producir entonces.

Tim Crow, profesor de psiquiatría en Oxford, ha aducido que se pueden identificar dos importantes acontecimientos especiadores con dos mutaciones estrechamente relacionadas del cromosoma. , producidas después de separarnos de los chimpancés. Hay motivos suponer que una de estas mutaciones, o las dos, están relacionadas con la asimetría cerebral y posiblemente con el lenguaje. Si es así, podríamos imaginar que la primera mutación se produjo en el antepasado común a Homo y a Paranthropus, y la segunda en Homo eructus, dado que éste acusa los primeros indicios de asimetría cerebral.
Reconstrucción de un Paranthopus boisei (Museo de Arqueología de Westfalia)
La investigación neurofisiológica moderna, sirviéndose de un abanico de técnicas de imágenes activas de la actividad cerebral, ha contribuido a erosionar la concepción biológica y determinista del pensamiento y de la evolución y adquisición del lenguaje. Sabemos ya que la sintasis de cada idioma se procesa en diferentes zonas cerebrales. La sintasis no se implanta: la infieren los niños, que en copmparación con los adultos que aprenden un idioma, tienen más capacidad y versatilidad para descodificar asociaciones simbólicas y adivinar la verdadera inferencia sintáctica.

Claro que, los humanos no somos los únicos que tenemos un período crítico en el desarrollo en el que se adquieren las técnicas lingüisticas. Se ha podido observar el mismo fenómeno en “cantores” no primates, los pájaros y las ballenas. Las complejas canciones, a menudo únicas, que cantan estos animales cuando son adultos se han aprendido, modificado y grabado en una etapa temprana. Además, las investigaciones demuestran que el habla no está forzosamente limitada a una zona o zonas concretas del cerebro.
Mucho nos queda por aprender de algunas especies que conviven con nosotros aquí en la Tierra y de las que, no sabemios nada o muy poco. Nadie sabe traducir los significados de esos cantos y sonidos que, entre ellos, se entrecruzan y, luego…¿quién podría negar que en “sus idiomas” entablan conversaciones?

En resumen, podríamos decir que, todas las facultades mentales y prácticas que los filósofos han aducido para señalar las diferencias cualitativas entre los humanos modernos y y los chimpancés, la única que sigue en pie es el lenguaje humano. Es evidente, hay una gran diferencia cuantitativa en lo que se refiere a la capacidad intelectual, pero el intelecto humano no brotó de pronto hace 35.000 años, en el Paleolítico Superior europeo: Ya venía evolucionando desde hace cuatro millones de años. Durante los dos últimos millones los humanos han mejorado el modelo del simio andante sirviéndose del cerebro, pero es posible que en este empeño les ayudara la coevolución del tamaño encefálico, impulsada por el lenguaje.
No tomeis a pie juntillas esa imagen de arriba que es indicadora de un equívoco muy común, partimos del mono y llegamos por evolución mutativa a ser humanos. Nada más incierto: Ambos, el Chimpancé y el humano, tuvieron un antepasado común del que divergieron un día, y, ese antepasado, no era ni Homo ni Pan.
emilio silvera
Fuente: Los Senderos del Eden de Stephen Oppenheimer
Oct
13
¡La curiosidad! Nos lleva al conocimiento de las cosas
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Queriendo saber ~
Clasificado en Queriendo saber ~
 Comments (0)
Comments (0)
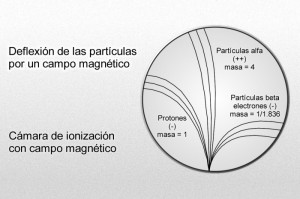
Poco tiempo después resultó evidente que existían otras subpartículas en el interior del átomo. Cuando Becquerel descubrió la radiactividad, identificó como emanaciones constituidas por electrones algunas de las radiaciones emitidas por sustancias radiactivas. Pero también quedaron al descubierto otras emisiones. Los Curie en Francia y Ernest Rutherford en Inglaterra detectaron una emisión bastante menos penetrante que el flujo electrónico. Rutherford la llamó rayos alfa, y denominó rayos beta a la emisión de electrones.
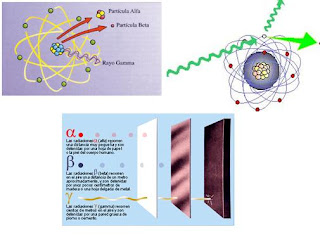
Los electrones volantes constitutivos de esta última radiación son, individualmente, partículas beta. Así mismo, se descubrió que los rayos alfa estaban formados por partículas, que fueron llamadas partículas alfa. Como ya sabemos, alfa y beta son las primeras letras del alfabeto griego y se escriben con los gráficos α y β.
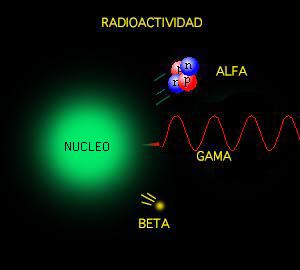
Entretanto, el químico francés Paul Ulrico Villard descubría una tercera forma de emisión radiactiva, a la que dio el nombre de rayos gamma, es decir, la tercera letra del alfabeto griego (γ). Pronto se identificó como una radiación análoga a los rayos X, aunque de menor longitud de onda.
Mediante sus experimentos, Rutherford comprobó que un campo magnético desviaba las partículas alfa con mucho menos fuerza que las partículas beta. Por añadidura, las desviaba en dirección opuesta, lo cual significaba que la partícula alfa tenía una carga positiva, es decir, contraria a la negativa del electrón. La intensidad de tal desviación permitió calcular que la partícula alfa tenía como mínimo una masa dos veces mayor que la del hidrogenión, cuya carga positiva era la más pequeña conocida hasta entonces.

En 1.909, Rutherford pudo aislar las partículas alfa. Puso material radiactivo en un tubo de vidrio fino rodeado por vidrio grueso, e hizo el vacío entre ambas superficies. Las partículas alfa pudieron atravesar la pared fina, pero no la gruesa, lo que dio lugar a que las partículas quedaran aprisionadas entre ambas, y Rutherford recurrió entonces a la descarga eléctrica para excitar las partículas alfa, hasta llevarlas a la incandescencia. Entonces mostraron los rayos espectrales del helio.

Hay pruebas de que laspartículas alfa producidas por sustancias radiactivas en el suelo constituyen el origen del helio en los pozos de gas natural. Si la partícula alfa es helio, su masa debe ser cuatro veces mayor que la del hidrógeno. Ello significa que la carga positiva de éste último equivale a dos unidades, tomando como unidad la carga del hidrogenión.
Más tarde, Rutherford identificó otra partícula positiva en el átomo. A decir verdad, había sido detectada y reconocida ya muchos años antes. En 1.886, el físico alemán Eugen Goldstein, empleando un tubo catódico con un cátodo perforado, descubrió una nueva radiación que fluía por los orificios del cátodo en dirección opuesta a la de los rayos catódicos. La denominó rayos canales.

Part of Astronomy that study physical and chemical characteristics of heavenly bodies. Astrophysics is the most important part of Astronomy at the present time owing to advance of modern physics. Doppler- Fizeau´s effect, Zeeman´s effect, quantum theories and thermonuclear reactions applied to study of heavenly bodies have permitted to discover the solar magnetic field, study stellar radiations and their processes of nuclear fusion, and determine radial velocity of stars, etc. Electromagnetic radiation of heavenly bodies permits to make spectrum analysis of themselves, and they are the principal fountain of information in this part of Astronomy
En 1.902, esta radiación sirvió para detectar por vez primera el efecto Doppler-Fizeau respecto a las ondas luminosas de origen terrestre. El físico alemán de nombre Johannes Stara orientó un espectroscopio de tal forma que los rayos cayeron sobre éste, revelando la desviación hacia el violeta. Por estos trabajos se le otorgó el premio Nobel de Física en 1.919.
Puesto que los rayos canales se mueven en dirección opuesta a los rayos catódicos de carga negativa, Thomson propuso que se diera a esta radiación el nombre de rayos positivos. Entonces se comprobó que las partículas de rayos positivos podían atravesar fácilmente la materia. De aquí que fuesen considerados, por su volumen, mucho más pequeños que los iones corrientes o átomos. La desviación determinada, en su caso, por un campo magnético, puso de relieve que la más ínfima de estas partículas tenía carga y masa similares a los del hidrogenión, suponiendo que este ión contuviese la misma unidad posible de carga positiva.
Por consiguiente se dedujo que la partícula del rayo positivo era la partícula positiva elemental, o sea, el elemento contrapuesto al electrón; Rutherford lo llamó protón (del neutro griego proton, “lo primero”).
Desde luego, el protón y el electrón llevan cargas eléctricas iguales, aunque opuestas; ahora bien, la masa del protón, referida al electrón, es 1.836 veces mayor (como señalo en el gráfico anterior).
Parecía probable pues que el átomo estuviese compuesto por protones y electrones, cuyas cargas se equilibraran entre sí. También parecía claro que los protones se hallaban en el interior del átomo y no se desprendían, como ocurría fácilmente con los electrones. Pero entonces se planteó el gran interrogante: ¿cuál era la estructura de esas partículas en el átomo?
El núcleo atómico

El propio Rutherford empezó a vislumbrar la respuesta. Entre 1.906 y 1.908 (hace ahora un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
En 1.908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.

Desde entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.

Con tres electrones, el litio es el elemento sólido más ligero
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de carga positiva en el núcleo atómico deben ser numéricamente idénticas a los electrones que contiene por norma, pues el átomo suele ser un cuerpo neutro, y esta igualdad de lo positivo con lo negativo es el equilibrio. De hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía el núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. Como es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.

Pero entre tanto se habían presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por número enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal, y ello dio lugar a una interesante historia.
Isótopos; construcción de bloques uniforme,
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.

Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.
Por entonces, Rutherford, a su vez, separó del torio un torio X muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que durante la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.
El material radiactivo llega a producir mutaciones.
Varios químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados. Entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
Hay que huir de los desechos radiactivos que causan la actividad del hombre
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907 los químicos americanos Herbert Newby McCoy y W. H. Ross descubrieron que el radiotorio (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio D, el mismo que el plomo, tanto que a veces era llamado radioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.
En 1.913, Soddy esclareció esta idea y le dio más amplitud. Demostró que cuando un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.

Soddy dio el nombre de isótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
El modelo protón–electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula alfa de un núcleo, se reducía en dos unidades la carga positiva de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!

¿Cómo se explica que cuando el torio se descompone en radiotorio después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta, y más tarde una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque en cierto modo, esto no afecta al resultado).
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía el número atómico 90, es decir, el mismo de antes.

El torio en estado natural
Así pues, el radiotorio, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de un átomo están sujetas al número de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o número másico. Así, el torio corriente se denomina torio 232, y el radiotorio, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones: plomo 210 (radio D), plomo 214 (radio B), plomo 212 (torio B) y plomo 211 (actinio B).

Se descubrió que la noción de isótopo podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206, la del torio en plomo 208 y la del actinio en plomo 207. cada uno de estos era un isótopo estable y corriente del plomo, pero los tres plomos diferían por su peso atómico.
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.

distintos isótopos
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.
En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección; demostró que 993 de cada 1.000 átomos de uranio eran de uranio 238 (no válido para combustible nuclear). Y muy pronto se haría evidente el profundo significado de tal descubrimiento.

Sí, sólo el 7 por 1000 del uranio existente en la Tierra, es combustible nuclear, es decir, Uranio 235. El resto, es Uranio 238 que hay que reciclarlo en un Acelerador Generador para convertirlo en Plutonio 239 que nos sirva como combustible nuclaer de fisión.
Así, después de estar siguiendo huellas falsas durantes un siglo, se reivindicó definitivamente la teoría de Prout. Los elementos estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
emilio silvera
Jul
15
Aquellos personajes: Faraday fue uno de ellos
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Queriendo saber ~
Clasificado en Queriendo saber ~
 Comments (0)
Comments (0)

Tal como la revolución copernicana en la astronomía, la revolución “del campo” en la física sería un desafío al sentido común y conduciría una vez más a los científicos pioneros a “las brumas de la paradoja”. Si Michael Faraday hubiese tenido una sólida formación matemática quizá no hubiera estado tan dispuesto a realizar su sorprendente recorrido. Hijo de un herrero pobre de las afueras de Londres, Faraday tuvo que ganarse la vida desde muy niño, y se dice que en tiempos de guerra, cuando los precios eran muy altos, pasaba una semana entera con una barra de pan. Sus padres pertenecían a una reducida secta protestante escocesa fundamentalista y practicante del ascetismo que, como los cuáqueros, creía en un clero laico y se oponía a la acumulación de bienes materiales.
Faraday asistía regularmente a las reuniones dominicales y fue uno de los dirigentes de la congregación hasta el final de su vida. Los pasajes más marcados de su muy leída Biblia se hallaban en el libro de Job. Faraday prácticamente no tuvo una educación formal-“poco más que los rudimentos de lectura, escritura y aritmética que se enseñan en una escuela corriente”- pero a los trece años entró afortunadamente a trabajar en el taller de un amistoso impresor y encuadernador francés emigrado, un tal monsieur Riebau. Al principio Faraday repartía los periódicos que Riebau prestaba, y los recogía posteriormente para llevarlos a otros clientes.

Hace más de doscientos años, cuando Faraday entró en la imprenta de George Riebau, todo era rústico y muy artesanal. En el mundo las cosas eran muy diferentes a las que hoy conocemos.
Entre los libros que llegaron al taller de Riebau para ser encuadernados estaba The improvement of the Mind ( “La perfección de la mente”), del escritor de himnos Isaac Watts, cuyo sistema para el perfeccionamiento de sí mismo siguió Faraday. Llevando un diario que luego se convertiría en su famoso cuaderno de laboratorio. Un día Faraday recibió en el taller para su encuadernación un tomo de la Enciclopedia Britannica ( 3.ª ed., 1797) que contenía un artículo de 127 páginas a doble columna sobre la electricidad de un fluido y de dos fluidos, y proponía que la electricidad no era un flujo material sino un tipo de vibración, semejante a la luz y el calor. Esta atractiva sugerencia marcó el comienzo de la carrera científica de Faraday.

En 1810 Faraday comenzó a asistir a las conferencias públicas de la Sociedad Filosófica de la Ciudad, y luego a las que daba Humphry Davy en la institución Real. En diciembre de 1811 Faraday causó una favorable impresión en Davy cuando le envió las notas, escritas con una hermosa letra y cuidadosamente encuadernadas, que había tomado en las conferencias del primero, acompañadas de una solicitud para que le contratara como auxiliar. Davy había quedado temporalmente ciego en octubre de ese mismo año a causa de una explosión que había acontecido en su laboratorio y necesitaba un amanuense. Contrató a Faraday por una guinea a la semana y el uso de doa habitaciones en el último piso de la institución, con combustible, velas y batas de laboratorio incluidos, además de la libertad para utilizar los aparatos. A los veinte años, Faraday se hallaba en el laboratorio de uno de los mayores químicos de la época, y podía experimentar allí a sus anchas. ¡ Un sueño hecho realidad !.Sir Humphry y lady Davy completaron la educación de Faraday llevándolo con ellos en una gira por el continente europeo en 1813-1814.
Visitaron Francia e Italia, conocieron a científicos y Faraday compartió las esperanzas y las dudas del parlanchín Davy. Cuando regresaron a Inglaterra en abril de 1815, Davy había inmunizado a Faraday contra las generalizaciones fáciles y había renovado su pasión por el experimento. De regreso en el laboratorio, Faraday experimentó con combustibles para calefacción y alumbrado, y finalmente descubrió el benceno. Elaboró los primeros compuestos de cloro y carbono, de los que salió el etileno, resultado de la primera reacción de sustitución conocida. Faraday también fue un pionero de la química de las aleaciones de acero. Con el tiempo se sabría que uno de los hechos cruciales de su vida fue el encargo, por parte de la Royal Society, que lo llevó a elaborar un nuevo cristal óptico “ grueso” con un alto índice de refracción especialmente útil para los experimentos con luz polarizada.

El temperamento optimista de Faraday se vio reforzado por un feliz matrimonio con la hermana de un individuo que había conocido en la Sociedad Filosófica de la Ciudad. Sarah Bernard nunca compartió los intereses científicos que hacían pasar a Faraday las noches en vela, pero decía que se sentía feliz de ser la “almohada de su mente”.
En ese mundo nuevo en que la prioridad era recompensada, los tempranos éxitos de Faraday despertaron la envidia de su famoso mentor. En 1824, cuando Faraday fue propuesto para ingresar en la Royal Society por haber logrado la licuefacción del cloro, Davy se opuso a su candidatura y afirmó que el mérito era suyo. A pesar de todo, Faraday fue elegido.

Davy se había sentido intrigado por los recientes esfuerzos teóricos para adaptar las ideas de Newton a las necesidades que experimentaba el químico en el laboratorio. El más atractivo de estos esfuerzos era la teoría del “punto central” de Boscovich, que describía el átomo no como una diminuta bola de billar de materia impenetrable, sino como un centro de fuerzas. Si las “partículas últimas” de materia tenían esta característica, se explicaría así la interacción de los elementos químicos, sus “afinidades” y los modos de formar compuestos estables.

Boscovich había limitado su atrevida sugerencia a los elementos químicos. Faraday, cuando por casualidad enfocó su pasión por el experimento sobre el poco explorado reino de la electricidad, sintió un renovado interés por la teoría de Boscovich. En 1821 un amigo solicitó a Faraday que escribiera un artículo extenso para el Philosophical Magazine explicando el electromagnetismo al público lego en la materia. En aquel momento había un gran interés por el tema, desde que el verano anterior el físico danés Hans Christian Oersted (1777-1851) había probado, durante una demostración realizada en una conferencia nocturna, que un alambre que condujera corriente eléctrica podía desviar una aguja magnética.
Siguiendo las ideas sugeridas por Oersted, Faraday inventó un sencillo aparato formado por dos cubetas que contenían mercurio, un alambre conductor de corriente y dos barras imantadas cilíndricas. Con esto él demostraba elegantemente la rotación electromagnética, probando que el alambre conductor rotaba alrededor del polo de un imán, y el polo de un imán hacía lo mismo en torno a un alambre conductor.

Quizá Faraday empezaba a sospechar que alrededor de un alambre conductor había líneas circulares de fuerza, y que tal vez las fuerzas del magnetismo y de la electricidad fueran convertibles. En este punto fue una suerte que Faraday no fuese un matemático refinado, pues si lo hubiese sido probablemente habría seguido el camino convencional, como el que tomó el prestigioso matemático francés André Marie Ampère (1775-1836), y hubiese tratado de explicar el electromagnetismo simplemente mediante una formulación matemática de los centros de fuerza newtonianos. Pero la ingenua mirada de Faraday percibió otra cosa.
Sin proponérselo, Faraday ya había realizado la primera conversión de energía mecánica en energía electrica. El viejo Einstein tenía en su despacho de Princeton una fotografía de Faraday que le acompañaba en todas sus elucubraciones sobre temas de física y le recordaba al mirarlo que las cosas se consiguen mediante el trabajo y la perseverancia.
emilio silvera















 Totales: 77.733.367
Totales: 77.733.367 Conectados: 39
Conectados: 39





























