Abr
22
¡Un Universo lleno de vida! ¿Cómo podría ser de otra manera?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (2)
Comments (2)

Cada día podemos llegar más lejos

Una característica sorprendente de nuestro retrato reconstruido del antepasado primitivo es su carácter moderno. Si este organismo lo encontráramos hoy, seguramente no delataría su inmensa antigüedad, excepto por sus secuencias de DNA. Tuvo que estar precedido, necesariamente, por formas más rudimentarias, estadios intermedios en la génesis de sistemas estructurales, metabólicos, energéticos y genéticos complejos que son compartidos por todos los seres vivos de hoy en día. Por desgracia, tales formas no han dejado descendientes igualmente primitivos que permitan su caracterización. Esta carencia complica mucho el problema del origen de la vida.

Pasados por un buen baño, una peluquería y con un buen traje, podrían, sin duda alguna, pasar inadvertido por cualquier calle de una de las muchas bulliciosas ciudades del mundo. Los cambios en nuestro físico son lentos y las pequeñas mutaciones que se están produciendo con el paso del tiempo, son imperceptibles para el ojo humano. Es, según creo, nuestro cerebro el que más ha cambiado en los últimos milenios.
Sabemos que la Tierra nació hace unos 4.550 millones de años. Se condensó, junto con los otros planetas del sistema solar, a partir de un disco de gas y polvo que giraba alrededor de una joven estrella que iba a convertirse en nuestro Sol. Fenómenos de violencia extrema, incompatible con el mantenimiento de ningún tipo de vida, rodearon este nacimiento. Durante al menos quinientos millones de años, cometas y asteroides sacudieron la Tierra en formación, con lo que la hicieron incapaz de albergar vida durante todo este tiempo. Algunos impactos pudieron haber sido incluso suficientemente violentos como para producir la pérdida de toda agua terrestre por vaporización, después de lo cual los océanos se habrían vuelto a llenar con agua aportada por cometas y por la que había dentro de las rocas que fue expulsada por evaporación. Según esta versión de los acontecimientos, los océanos actuales de remontarían a la última oleada de bombardeo cometario intenso y a la intensa actividad volcánica, que los expertos creen que tuvo lugar hace unos cuatro mil millones de años. Existen señales de que había vida en la Tierra poco después de que dichos cataclismos llegaran a su fin. En las rocas que han sido datadas más antiguas del planeta (con 3.800 millones de años), se encontraron fósiles de bacterias.
Algunos investigadores creen que el tiempo que pasó entre el momento en el que la Tierra se hizo habitable y aquel en el que apareció la vida, fue demasiado corto para que surgiera algo tan complejo como una célula viva. De ahí la hipótesis de que la vida pudo llegar desde otro lugar. ¿Qué debemos pensar de ello?
¿ Que la vida llegó del espacio exterior?
Svante Arrhenius
La teoría de que la vida es de origen extraterrestre ha tenido ilustres defensores. Entre ellos, el químico sueco Svante Arrhenius, ganador del premio Nobel de química de 1903 y recordado hoy por su concepción profética del efecto invernadero, acuñó el término “panspermia” para su teoría de que hay gérmenes de vida que existen en todo el cosmos y caen continuamente sobre la Tierra. Más recientemente, un célebre astrónomo inglés, sir Fred Hoyle, quien murió en 2001, afirmó, junto con un colega de Sri Lanka, Chandra Wickramasinghe, haber detectado pruebas espectroscópicas de la presencia de organismos vivos en cometas. Más adelante veremos cuáles son estas pruebas. Francis Crick, codescubridor con James Watson de la estructura en doble hélice del DNA, ha propuesto incluso, con otro científico de origen inglés, Leslie Orgel, que los primeros organismos vivos pudieron haber alcanzado la Tierra a bordo de una nave espacial enviada por alguna “civilización distante”. Ha dado el nombre de “panspermia directa” a esta hipótesis.

La Imaginación desbocada no deja de configurar escenarios que pudieron ser
Dejando a un lado la nave espacial, de la que hasta ahora no se ha encontrado señal alguna, un origen extraterrestre de la vida es perfectamente verosímil. La objeción que tantas veces se ha manifestado de que organismos vivos no podrían soportar las condiciones físicas que hay en el espacio, especialmente la intensa radiación ultravioleta, no se sostiene, porque rápidamente se advierte que cometas o meteoritos pueden ofrecer protección a los organismos. La destrucción por el calor durante su entrada en la atmósfera terrestre podría evitarse de forma similar. Además, la posibilidad de que la vida pueda ser un fenómeno extendido, que exista en muchos lugares del universo, es algo que tiene cada vez más adeptos. Así, la eventualidad de que organismos vivos viajen a través del espacio en varios “objetos voladores” está lejos de ser inverosímil. Pero…, ¿Qué hay de las pruebas?
Bombardeo de cometas y asteroides sobre la Tierra ígnea primigenia
La argumentación de que no hubo tiempo suficiente para que la vida surgiera localmente en la Tierra se basa en una valoración puramente subjetiva y arbitraria, que no está corroborada por ningún elemento objetivo. No existe prueba alguna de que la aparición de la vida requiera cientos de millones de años, como algunos afirman, toda vez que, una vez que existen las condiciones para ello… Por el contrario, la visión esencialmente química y determinista que hay que tener del fenómeno de la vida lleva a creer, más bien, que la vida surgió de manera relativamente rápida, en un período de tiempo que con probabilidad hay que contar en milenios y no en millones de años, Según esta concepción, el margen de unos cien millones de años que permiten los datos actuales deja tiempo suficiente para que la vida naciera en la Tierra. Es incluso posible que la vida surgiera y desapareciera varias veces antes de establecerse de manera definitiva.
El Telescopio ALMA detecta moléculas de Azúcar en la Pata del Gato
Buscar moléculas de azúcar en el espacio exterior, sería una manera de acercarnos a posibles formas de vida en las que, estas moléculas están presentes y, como sabéis (la imagen de arriba lo demuestra), han sido halladas tales moléculas por el potente radio-telecopio ALMA en el norte de Chile que permitió detectarlas moléculas en torno a una estrella joven, similar al sol, un inédito hallazgo para la ciencia, según el Observatorio Europeo Austral (ESO).
Quedan todas esas observaciones, claramente innegables, que demuestran que los constituyentes elementales de la vida existen en cometas y otros objetos celestes. Pero, ¿estas sustancias son producto de la vida, como creen los defensores de la panspermia? ¿O bien son, por el contrario, el fruto de reacciones químicas espontáneas? la segunda explicación se considera la más probable de las dos.
“Alrededor de las nebulosas planetarias Tc-1 y M1-20, entre 600 y 2.500 años luz de la Tierra, un equipo de investigadores del Instituto de Astrofísica de Canarias (IAC) ha hallado por primera vez evidencias de fullerenos complejos, denominados «cebollas de carbono», las moléculas más complejas observadas hasta el momento en el espacio exterior. Un hallazgo que tiene importantes implicaciones a la hora de entender la física y química del Universo y del origen y composición de las bandas difusas interestelares (DIBs), uno de los fenómenos más enigmáticos de la astrofísica.”
Es probable que los procesos que tienen lugar en el espacio exterior hayan llevado a que las moléculas biológicas se encuentren exclusivamente en forma destrógira o levógira. Esta es la conclusión que arroja unos experimentos llevados a cabo en la instalación de sincrotrón SOLEIL cerca de París, en la cual se encontró que un número de moléculas simples en regiones de formación estelar expuestas a radiación polarizada creaban aminoácidos con un desequilibrio de moléculas dextrógiras y levógiras.
Las conocidas como m0léculas quirales pueden existir en dos formas, siendo una la imagen especular no superponible de una sobre la otra, incluso aunque ambas tienen la misma composición química. Si bien los experimentos de laboratorio tienden a producir cantidades iguales de las versiones dextrógiras y levógiras, muchas de las moléculas quirales encontradas en organismos vivos proceden de una de las variedades. Por ejemplo, los aminoácidos que forman las proteínas solo aparecen en la forma levógira, mientras que los azúcares del ADN sólo en la dextrógira.

Ahora se cree que es posible que moléculas como las encontradas en esta gigantesca nube, hayan sido de gran ayuda para crear la vida en la Tierra. Estamos en la inmensa Orión, ahí, el mayor Laboratorio químico que podamos imaginar harían las delicias de todos los químico/as de la Tierra y, no digamos de los astrónomos que darían “parte de su vida” por ver, in situ, como se forman las estrellas nuevas y los nuevos mundos. También ahí están presentes transformaciones maravillosas que van dejando a punto esos “ladrillos” constituyentes que darán lugar a que, en alguno de los mundo que pululan por estrellas nuevas, pueda surgir la vida.
Tenemos un amplio campo de complejas respuestas que tenemos que desvelar, descorriendo para ello el velo de ignorancia que cubre nuestras mentes. En este difícil tema de la Vida, aunque mucho es lo que hemos llegado a comprender, es mucho más lo que de ella ignoramos y, nadie, hasta el momento ha podido decir con palabras plenas qué es la Vida, cómo pudio surgir o de dónde llegó la semilla que germinó en nuestro planeta. Sin embargo, aquí está, en mil formas y estados que nos producen asombro y hacen despertar nuestra curiosidad y nos empuja a querer llegar a comprender, lo que la vida es.
¡Desde una charca fangoza y caliente, hasta la copa de los árboles! Para seguir ese largo camino hacia los pensamientos y, una vez alcanzada la consciencia de Ser, tratar de llegar a las estrellas. No, no ha sido fácil ni corto el camino que hemos tenido que recorrer y, aunque sólo sea una fracción del tiempo del Universo, para nosotros, la especie humana, es muchísimo tiempo en el que, hemos podido llegar a comprender que, aún nos queda mucho por hacer.
Resolver el misterio de la biogénesis no es sólo un problema más en una larga lista de proyectos científicos indispensables. Como el origen del Universo y el origen de la consciencia, representa algo en conjunto mucho más profundo, puesto que pone a prueba las bases mismas de nuestra ciencia y nuestra visión del mundo. El misterio del origen de la Vida a intrigado a filósofos, teólogos y científicos durante más de dos mil quinientos años. Durante las próximas décadas, tenemos la oportunidad de hacer algunos descubrimientos importantes y llevar a buen término avances fundamentales en este campo, La Astrofísica nos puede dar algunos de los secretos mejor guardados que, de manera inesperada, podrían estar fuera de nuestro mundo.
emilio silvera
Abr
22
Aprender de la Naturaleza
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Hoy conocemos los núcleos presentes en el Universo. La Astrofísica nuclear es una rama relativamente joven de la física entre cuyos objetivos destaca la descripción de las reacciones mediante las cuales tiene lugar la generación de energías y la síntesis de elementos químicos en el Universo. Se trata, por tanto, de un campo multidisciplinar que combina las observaciones astronómicas, con el análisis de la composición de meteoritos, la modelización astrofísica y la física nuclear tanto experimental como teórica.

Fred Hoyle
En 1957, E.M. Burbidge, W.A. Fowler and F. Hoyle y de manera independiente A.G.W. Cameron publicaron sendos artículos clave, donde definen los principales procesos que explican la transformación de unos núcleos en otros, asentados en base de la Astrofísica nuclear.
A lo largo de la segunda mitad del siglo XX, la Astrofísica nuclear ha conseguido importantes logros que sin duda están íntimamente conectados al impresionante avance experimentado por las técnicas instrumentales y de medidas asociadas y por la capacidad de cálculo.
La nucleosíntesis es el proceso por el que las reacciones nucleares transforman unos elementos químicos en otros. El elemento más sencillo es el hidrógeno, cuyo núcleo atómico consta normalmente de un solo protón. El número de protones determina la naturaleza del elemento químico.

Los diferentes procesos de nucleosíntesis que tienen lugar durante la vida de una estrella dan lugar a la creación de nuevos elementos químicos que son expulsados al medio interestelar. Estos elementos pasan a formar parte de una nueva generación de estrellas, y pueden ser detectados mediante estudios espectroscópicos. La mejora de las técnicas utilizadas en la instrumentación observacional y de los métodos de detección espectroscópicos, la construcción de grandes telescopios como el VLT y el Keck a los que pronto se añadirá el Gran TeCan, y la posibilidad de hacer observaciones desde el espacio sin la interferencia de la atmósfera terrestre (Telescopio Hubble, Chandra, XMM Newton e Integral), ha permitido obtener toda una nueva visión del universo que nos rodea.

Decaimiento β– de un núcleo. Se observa como uno de los neutrones se transforma en un protón emitiendo un electrón (β–) y un anti-neutrino electrónico.
En algunos casos se miden reacciones inducidas por núcleos estables y energías próximas a las que se dan en las estrellas, con secciones eficaces muy pequeñas, que necesitan el uso de instalaciones subterráneas capaces de blindar los equipos de detección a la radiación de origen cósmico. En otros casos, se estudian reacciones inducidas por núcleos inestables (también llamados núcleos exóticos), con una vida media muy corta, y difíciles de sintetizar en el laboratorio con la tecnología actual.



No obstante, en las últimas décadas, numerosas instalaciones de haces de núcleos exóticos (Louvain la Neuve, GANIL, GSI, ISOLDE) han desarrollado programas experimentales en los que se han determinado las propiedades fundamentales (masas y vidas medias) y propiedades de la estructura de núcleos claves en reacciones de interés Astrofísico. Igualmente se han medido un número importante de secciones eficaces asociadas a los diferentes procesos de nucleosíntesis. Por otro lado, la construcción de instalaciones de tiempo de vuelo de neutrones (n_ToF arroba CERN) ha permitido el desarrollo de programas dedicados al estudio de la captura neutrónica. Así mismo, las nuevas instalaciones que se construirán en los próximos años (FAIR, SPIRAL 2) incluyen en sus programas científicos el estudio de reacciones nucleares de interés astrofísico.
En la mayor parte de los Modelos Astrofísicos la Física Nuclear Teórica es necesaria para convertir un texto experimental en el ritmo de reacción que es necesario en la aplicación astrofísica concreta. Ahora mismo nos encontramos al comienzo de una nueva era de desarrollo de modelos teóricos basados en primeros principios (ab-anitio). Esto permitirá reducir las incertidumbres asociadas con extrapolaciones a regiones de la carta de núcleos que no han sido exploradas experimentalmente, pero que son relevantes para diferentes procesos astrofísicos como es el caso de núcleos muy ricos en neutrones para el proceso r.
De forma complementaria, se han producido grandes avances en la modelización astrofísica de las diferentes etapas de evolución estelar. Los desafíos actuales se centran en la realización de simulaciones en tres dimensiones espaciales de los diferentes fenómenos astrofísicos y en particular de las espectaculares explosiones de supernovas tanto termonucleares como debidas al colapso gravitatorio.

Físicos en el Laboratorio Nacional Argonne en Chicago han utilizado el superordenador IBM Blue Gene/P para modelar la extrema física de una explosión de supernova. La visualización de arriba del superordenador del Laboratorio Nacional de Argonne logró mostrar el mecanismo de la muerte violenta de una estrella masiva, después de una corta vida. La imagen muestro en colores los valores de energía en el núcleo de la supernova. Se asignaron diferentes colores y transparencias a diferentes valores de enstrofía. Ajustando selectivamente el color y la transparencia, los científicos pueden “pelar” las capas externas y ver lo que está sucediendo en el interior de la estrella.
Arriba, varias visualizaciones de la combustión nuclear en una supernova.
El Modelo cosmológico del Big Bang parte de la hipótesis de que nuestro Universo actual es el resultado de la expansión desde un estado inicial extremadamente denso y caliente. Al expandirse la temperatura decrece, lo que permite la formación de neutrones y protones a partir de una “sopa” inicial de Gluones y Quarks. En este momento comienza la época de nucleosíntesis primordial que dura aproximadamente 3 minutos. Debido a la gran cantidad de fotones presentes (altas temperaturas), la rápida expansión y al hecho de que no existen núcleos estables con un número de nucleones (protones y neutrones) igual a 5 y 8, los únicos elementos producidos son principalmente Hidrógeno y Helio (³He y ⁴He) con abundancias residuales de Deuterio y Litio (⁶Li y ⁷Li).
Las predicciones para las abundancias de elementos producidas durante el Big Bang están de acuerdo con las observaciones con las abundancias de Deuterio y Helio (⁴He), para un valor de la razón de fotones a bariones que es consistente con las observaciones recientes del fondo de microondas. Es importante resaltar que (BBN), es decir, es la época de la nucleosíntesis primordial, la que nos permite “observar” el universo cuando éste tenía sólo unos pocos minutos de edad, mientras que el fondo de microondas corresponde a una edad de unos 300 mil años. A pesar del buen acuerdo en la predicción de los elementos más ligeros, la teoría predice una abundancia de Litio (⁷Li) superior en un facto 2-3 a la observada. Este hecho ha desencadenado toda una serie de estudios observacionales con el objetivo de determinar las abundancias primordiales de ⁶Li y ⁷Li junto con nuevas medidas experimentales de las reacciones ⁷Be (d.p)2α u d(α, γ)⁶Li.
Evolución de las estrellas
Dado que en el Big Bang solamente se produjo hidrógeno y helio, el resto de los elementos tienen que sintetizarse en otro lugar. Actualmente, está bien establecido que la producción de elementos ligeros ocurre mediante las reacciones de fusión que tienen lugar en el interior de las estrellas. La secuencia está reflejada en el gráfico abajo.
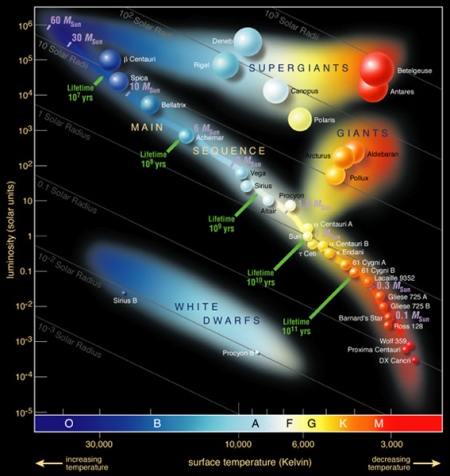
Procesos Nucleares y Nucleosíntesis durante la Combustión Hidrostática.
Las estrellas se forman a partir de la contracción de grandes nubes moleculares por su propia gravedad, Estas nubes están constituidas principalmente de hidrógeno y helio, junto con pequeñas trazas de otros elementos más pesados que en la astrofísica se denominan metales y que han sido formados en anteriores explosiones de supernova.
Podemos decir que una estrella nace en el momento en el que la temperatura en su centro es lo suficientemente elevada para desencadenar los primeros procesos de combustión nuclear. Una estrella se puede definir como una esfera de gas auto-luminosa. Dado que el Sol es la estrella que mejor conocemos es conveniente tomarlo como referencia a la hora de definir propiedades estelares. El Sol posee un radio de unos 700 mil kilómetros, lo que equivale a 109 veces el radio de la Tierra. Su masa es 330 mil veces la masa de la Tierra. La temperatura en su superficie es de 6000 grados, mientras que en el centro es de 15 millones de grados. Allí la densidad es de 160 veces la densidad del agua. El Sol emite cada segundo la misma energía que consumiríamos en la Tierra durante 4 millones de años al ritmo actual de consumo de energía.

Dado que cuando nacen las estrellas están constituidas principalmente por hidrógeno, un mecanismo natural para explicar la generación de energía es la fusión de 4 núcleos de Hidrógeno (protones) para dar un núcleo de Helio (partícula alfa, α) Hans Bethe propuso una explicación a este proceso en 1939, al sugerir la existencia de dos posibles mecanismos hoy denominados cadena pp y ciclo CON. El resultado neto de ambos procesos es la conversión de cuatro protones en un núcleo de Helio que puede escribirse de manera simbólica por la relación
4¹H → ⁴H + 2e⁺+ 2ѵe + energía,
En la que además de un núcleo de Helio (³He, partícula α) se producen dos positrones (e+) y dos neutrinos electrónicos (ѵe). La energía librada en el proceso equivale a un 0,7% de la masa inicial de los cuatro núcleos de hidrógeno. La diferencia de masa se convierte en energía. Para poder mantener su ritmo de emisión de energía, el Sol necesita convertir 600 millones de toneladas de Hidrógeno en 596 millones de toneladas de Helio cada segundo, lo que significa que el Sol continuará quemando Hidrógeno a este ritmo durante los próximos 5.000 millones de años (más o menos).
Gigante roja primero y enana blanca después
Cuando llegue el momento en que el Sol consuma su combustible nuclear, todos sabemos bien que se convertirá primera en gigante roja y más tarde, expulsando materia que formará una Nebulosa Planetaria, quedará como enana blanca.
Conforme la temperatura en el centro de la estrella aumenta llega un momento en que la combustión del Helio comienza a ser posible. Podría pensarse que la combustión del Helio procede mediante la fusión de dos núcleos de Helio para dar un núcleo de ⁸Be. Sin embargo, eso no es posible dado que el ⁸Be no es estable y se desintegra nada más formarse. No obstante, su tiempo de vida es lo suficientemente largo (10⁻¹⁶ segundos) como para capturar otro núcleo de Helio y dar lugar a ¹²C mediante el proceso que es comúnmente conocido como “reacción triple alfa”.
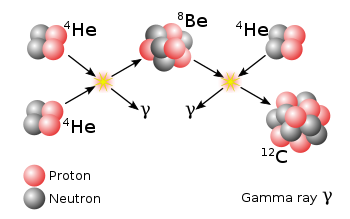
Parte del Carbono formado reacciona con los núcleos de Helio presentes y produce Oxígeno mediante la reacción ¹²C(α, γ)¹⁶O. Esta última reacción es probablemente la más importante en astrofísica nuclear dado que su ritmo determina la proporción de Carbono y Oxígeno resultante de la combustión de Helio. Esta proporción tiene importantes consecuencias en la determinación de la composición de las enanas blancas y la evolución con masas mayores de 8 masas solares.
La reacción triple alfa ha sido objeto de un estudio experimental reciente donde los estados relevantes del ¹²C han sido poblados mediante las desintegraciones beta del ¹²N y ¹²B. El mismo equipo experimental ha completado el estudio anterior mediante la reacción ¹⁰B(³He, pααα). Este último experimento se ha realizado en el recientemente inaugurado acelerador Tanden del Centro de Micro-análisis de Materiales de la Universidad Autónoma de Madrid.
Las etapas siguientes de la vida de una estrella dependen de su masa. Estrellas con masas menores a aproximadamente 8 masas solares no alcanzan en su centro la temperatura suficiente para iniciar la combustión del Carbono. Estas estrellas finalizan sus vidas expulsando sus capas exteriores, dando así lugar a la formación de una Nebulosa Planetaria que contiene, aproximadamente, la mitad de la masa inicial de la estrella.
En el centro de la Nebulosa queda una pequeña estrella que se contrae más y más hasta originar una enana blanca. En 1930, Subrahmanyan Chandrasekhar demostró la existencia de un valor máximo para la masa de una enana blanca, conocido como masa límite de Chandrasekhar. Una estrella con una masa mayor (~ 1,44 masas solares) no es estable y colapsa.
Las estrellas con masas mayores de 8 masas solares pasan por sucesivas etapas de combustión y contracción quemando cada vez elementos más pesados. Las diferentes etapas de combustión son: combustión de Carbono, Neón, Oxígeno, y finalmente Silicio. Cada uno de estos procesos de combustión ocurre a temperaturas cada vez más elevadas como se ha podido comprobar en presencia de grandes densidades y temperaturas en el centro de la estrella de 25 masas solares durante sus diferentes etapas de combustión nuclear.
emilio silvera
Abr
22
Conociendo la materia
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
El núcleo atómico está formado por los nucleones formados por tripletes de Quarks allí confinados por la fuerza nuclear fuerte y sujeto por los Bosones llamados Gluones. El núcleo atómico contiene más del 99% de la masa del átomo.
Entre 1.906 y 1.908 (hace ahora un siglo) Rutherford realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol). Pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido.
Rutherford supuso que aquellas “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad, desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo.)
En 1.908 se concedió a Rutherfor el premio Nóbel de Química, por su extraordinaria labor de investigación sobre la naturaleza de la materia. El fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden descubrir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón -es decir, una partícula subatómica-, lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.

El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ion. Y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de una carga positiva en el núcleo atómico deben ser numéricamente idéntica a los electrones que contiene como norma, pues el átomo suele ser un cuerpo neutro y esta igualdad de lo positivo con lo negativo, es el equilibrio. Y, de hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero, en cambio, se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero, como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía del núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable, neutralizaba dos unidades de su carga. Como es natural, se pensó también –en el electrón-. Se podría componer el rompecabezas si se suponía que el núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva.
El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta) reforzó esta idea general.
Dicha teoría prevaleció durante más de una década, hasta que, por caminos indirectos, llegó una respuesta mejor, como resultado de otras investigaciones.
Pero entretanto se había presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿Cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por números enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo del hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal. Y ello dio lugar a una interesante historia.
ÍSOTOPOS
Construcción de bloques uniformes
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía de entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado a 16). El cloro (según dije antes) tiene un peso atómico aproximado de 35’5, o para ser exactos, de 35’457. Otros ejemplos son el antimonio, con un peso atómico de 121’75; el bario, con 127’34; el boro, con 10’811, y el cadmio, con 112’40.
Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del “tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.
Por entonces, ivo, y cRutherfor, a su vez, separó del torio un “torio X” muy radiante comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.
Actinio C
Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.
El isótopo más común del uranio es el 238, en que los 92 protones van acompañados por el germanio (32), el estaño (50) y el plomo (82).
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radio-torio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radio-torio, una forma de torio; el radio-plomo, un miembro de una familia de plomos, y así sucesivamente.
En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radio-torio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.
Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nóbel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.
¿Cómo se explica que cuando el torio se descompone en “radio-torio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radio-torio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radio-torio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radio-torio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”
Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.
La materia tiene muchos secretos que están por desvelar, y, no dejamos de investigar para poder llegar a las respuestas planteadas que, de momento, no han tenido contestación.
emilio silvera
Abr
22
Conociendo la materia II
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Un isótopo estable es un nucleido que no es radiactivo (a diferencia de los radionucleidos), por lo que no experimenta de forma espontánea decaimiento radiactivo. Un elemento químico tiene uno o varios isótopos, de los cuales todos, algunos o ninguno, pueden ser estables. Los isótopos que no son estables (radioisótopos), a diferencia de los estables, se desintegran para dar lugar a otros nucleidos emitiendo partículas o radiación electromagnética.
Se conocen 2.500 nucleidos, de los cuales son estables menos de 300. La representación del número de neutrones (N) frente al número de protones (número atómico, Z) indicándose los isótopos estables se denomina carta de Sagre‘. Un ejemplo que podemos pomer es que el Tecnecio no tiene ningún isótopo estable, mientras que el estaño tiene diez isótopos estables.
Francis William Aston y el esquema de su invento

Mediante un dispositivo inventado por cierto ayudante de J.J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra, 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo por cada diez. (Mas tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.)
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban, el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas –el peso atómico- era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la “proporción” de cuatro a uno. En 1.922 se le otorgó el premio Nóbel de Química.
El Uranio 235 es combustible nuclear, el uranio 238 no lo es. Sin embargo, si ponemos uranio 238 en la base de un reactor generador y lo bombardeamos con neutrones lentos del uranio 235, el resultado será que se convierte en Plutonio 239 que sí es válido como combustible nuclear. El Uranio 235 solo supone el 7 por mil del Uranio de la Tierra, el resto es uranio 238.
En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección. Demostró que, si bien 993 de cada 1.000 átomos de uranio grande uranio 238 (no válido para combustible nuclear), los siete restantes eran uranio 235 (buen combustible nuclear). Y, muy pronto se haría evidente el profundo significado de tal descubrimiento.
Así, después de esta siguiendo huellas falsas durante un siglo, se reivindicó definitivamente la teoría de Prout. Los elementes estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.

¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
Ha pasado mucho tiempo desde que Rutherford identificara la primera partícula nuclear (la partícula alfa). El camino ha sido largo y muy duro, con muchos intentos fallidos antes de ir consiguiendo los triunfos (los únicos que suenan), y muchos han sido los nombres que contribuyeron para conseguir llegar al conocimiento del átomo y del núcleo actual: Los electrones circulando alrededor del núcleo, en sus distintos niveles, con un núcleo compuesto de protones y neutrones que, a su vez, son constituidos por los quarks allí confinados por los gluones, las partículas mediadoras de la fuerza nuclear fuente.
Pero ¿Qué habrá más allá de los quarks?
¿Las supercuerdas vibrantes?
¡Algún día se sabrá!
Partículas
El Universo de las partículas es fascinante. Cuando las partículas primarias chocan con átomos y moléculas en el aire, aplastan sus núcleos y producen toda clase de partículas secundaria. En esta radiación secundaria (aún muy energética) la que detectamos cerca de la Tierra, por los globos enviados a la atmósfera superior han registrado la radiación primaria.
El físico estadounidense Robert Andrews Millikan, que recogió una gran cantidad de información acerca de esta radiación (y que le dio el nombre de rayos cósmicos), decidió que debería haber una clase de radiación electromagnética. Su poder de penetración era tal que, parte del mismo, atravesaba muchos centímetros de plomo. Para Millikan, esto sugería que la radiación se parecía a la de los penetrantes rayos gamma, pero con la longitud de onda más corta.
Los rayos cósmicos que consiguen llegar a la superficie del planeta tienen consecuencia para nosotros
Otros, sobre todo el físico norteamericano Holly Compton, no estaban de acuerdo en que los rayos cósmicos fuesen partículas. Había un medio para investigar este asunto. Si se trataba de partículas cargadas, deberían ser rechazadas por el campo magnético de la Tierra al aproximarse a nuestro planeta desde el espacio exterior. Compton estudió las mediciones de la radiación cósmica en varias latitudes y descubrió que en realidad se curvaban con el campo magnético: era más débil cerca del ecuador magnético y más fuerte cerca de los polos, donde las líneas de fuerza magnética se hundían más en la Tierra.
Las partículas cósmicas primarias, cuando entran en nuestra atmósfera llevan consigo unas energías fantásticas, muy elevadas. En general, cuanto más pesado es el núcleo, más raro resulta entre las partículas cósmicas. Núcleos tan complejos como los que forman los átomos de hierro se detectaron con rapidez, en 1.968, otros núcleos tan complejos como los del uranio. Los núcleos de uranio constituyen sólo una partícula entre 10 millones. También se incluirán aquí electrones de muy elevada energía.
Ahora bien, la siguiente partícula inédita –después del neutrón- se descubrió en los rayos cósmicos. A decir verdad, cierto físico teórico había predicho ya este descubrimiento.
Paul Adrien Maurice Dirac había aducido, fundándose en un análisis matemático de las propiedades inherentes a las partículas subatómicas, que cada partícula debería tener su “antipartícula”. (Los científicos desean no sólo que la Naturaleza sea simple, sino también simétrica.) Así pues, debería haber un “antielectron”, salvo por su carga, que sería positiva, y no negativa, idéntico al electrón, y un “antiprotón” con carga negativa en vez de positiva.
En 1.930, cuando Dirac expuso su teoría, no llamó demasiado la atención en el mundo de la ciencia. Pero, fiel a la cita, dos años después apareció el “anti-electron”. Por entonces, el físico americano Carl David Anderson trabajaba con Millikan, en un intento por averiguar si los rayos cósmicos eran radiación electromagnética o partículas. Por aquellas fechas, casi todo el mundo estaba dispuesto a aceptar las pruebas presentadas por Compton, según las cuales, se trataría de partículas cargadas; pero Millikan no acababa de darse por satisfecho con tal solución.
Anderson se propuso averiguar si los rayos cósmicos que penetraban en una cámara de ionización se curvaban bajo la acción de un potente campo magnético. Al objeto de frenar dichos rayos lo suficiente como para detectar la curvatura, si la había, puso en la cámara una barrera de plomo de 6’35 mm de espesor. Descubrió que, cuando causaba el plomo, la radiación cósmica trazaba una estela curva a través de la cámara. Y descubrió algo más. A su paso por el plomo, los rayos cósmicos energéticos arrancaban partículas de los átomos de plomo. Una de esas partículas dejó una estela similar a la del electrón. ¡Allí estaba, pues, el “antielectron” de Dirac! Anderson le dio el nombre de “positrón”. Tenemos aquí un ejemplo de radiación secundaria producida por rayos cósmicos. Pero aún había más, pues en 1.963 se descubrió que los positrones figuraban también entre las radiaciones primarias.
Abandonado a sus propios medios, el positrón es tan estable como el electrón (¿y por qué no habría de serlo, si es idéntico al electrón, excepto en su carga eléctrica?). Además, su existencia puede ser indefinida. Ahora bien, en realidad no queda abandonado nunca a sus propios medios, ya que se mueve en un universo repleto de electrones. Apenas inicia su veloz carrera (cuya duración ronda la millonésima de segundo), se encuentra ya con uno.
Así, durante un momento relampagueante quedaran asociados el electrón y el positrón; ambas partículas girarán en torno a un centro de fuerza común. En 1.945, el físico americano Arthur Edwed Ruaark sugirió que se diera el nombre de “positronio” a este sistema de dos partículas, y en 1.951, el físico americano de origen austriaco Martín Deutch consiguió detectarlo guiándose por los rayos gamma característicos del conjunto.
Pero no nos confundamos, aunque se forme un sistema positronio, su existencia durará, como máximo, una diezmillonésima de segundo. El encuentro de electrón-positrón=aniquilamiento mutuo, solo queda energía en forma de radiación gamma. Ocurre pues, tal como había sugerido Einstein: la materia puede convertirse en energía y viceversa. Por cierto que Anderson consiguió detectar muy pronto el fenómeno inverso: desaparición súbita de los rayos gamma, para dar origen a una pareja electrón-positrón. Este fenómeno se llama “producción en pareja.” Anderson compartió con Hess el premio Nóbel de Física de 1.936.
Poco después, los Joliot-Curie detectaron el positrón por otros medios, y, al hacerlo así, realizaron, de paso, un importante descubrimiento. Al bombardear los átomos de aluminio con partículas alfa, descubrieron que con tal sistema no solo se obtenían protones, sino también positrones. Cuando suspendieron el bombardeo, el aluminio siguió emitiendo positrones, emisión que sólo con el tiempo se debilitó.
Aparentemente habían creado, sin proponérselo, una nueva sustancia radiactiva.
He aquí la interpretación de lo ocurrido, según los Joliot-Curie: Cuando un núcleo de aluminio absorbe una partícula alfa, la adición de los dos protones transforma el aluminio (nº atómico 13 en fósforo (nº atómico 15). Puesto que las partículas alfa contienen cuatro nucleones en total, el número masivo se eleva 4 unidades, es decir, del aluminio 27, al fósforo 31. Ahora bien, si al reaccionar se expulsa un protón de ese núcleo, la reducción en una unidad de sus números atómicos y masivos hará surgir otro elemento, o sea, el silicio 30.
Puesto que la partícula alfa es el núcleo del helio, y un protón es el núcleo del hidrógeno, podemos escribir la siguiente ecuación de esta “reacción nuclear”:
aluminio 27+helio4®silicio30+hidrogeno1
Nótese que los números másicos de equilibran:
27+4= a 30+1
Adentrarse en el Universo de las partículas que componen los elementos de la Tabla periódica, y, en definitiva, la materia conocida, es verdaderamente fantástico.
emilio silvera















 Totales: 67.199.735
Totales: 67.199.735 Conectados: 58
Conectados: 58























