Dic
14
Poco a poco, hemos podido saber lo que la materia es
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (0)
Comments (0)
AVANCES DE LA HUMANIDAD


Ha pasado más de un siglo desde que se hicieron una serie de observaciones desconcertantes, que condujeron al esclarecimiento de algunas cuestiones antes oscuras. El inglés William Crookes (el del “tubo Crookes”) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”.
Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.
Por entonces, Rutherford, a su vez, separó del torio un “torio X” muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.
Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).

En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radiotorio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos, y así sucesivamente.

Frederick Soddy
En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radiotorio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.
Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nóbel de Química.

El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.
¡Maravilloso!
Lo de maravilloso de antes, es que me entusiasmo con los movimientos que lleva a cabo la naturaleza para conseguir sus fines.
¿Cómo se explica que cuando el torio se descompone en “radiotorio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)

El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radiotorio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radiotorio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:
Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”
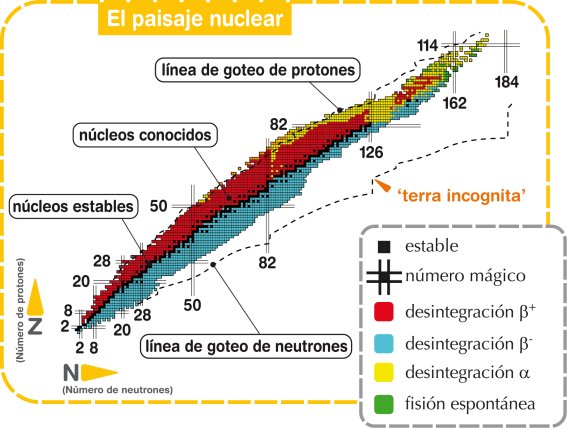
Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.

Francis William Aston en 1922
Mediante un dispositivo inventado por cierto ayudante de J.J.Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra, 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo por cada diez. (Mas tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.)


Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban, el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas -el peso atómico- era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la “proporción” de cuatro a uno. En 1.922 se le otorgó el premio Nóbel de Química.

En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección. Demostró que, si bien 993 de cada 1.000 átomos de uranio ordinario, uranio 238 (no válido para combustible nuclear), los siete restantes eran uranio 235 (buen combustible nuclear). Y, muy pronto se haría evidente el profundo significado de tal descubrimiento.

Así, después de estar siguiendo huellas falsas durante un siglo, se reivindicó definitivamente la teoría de Prout. Los elementes estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
Gracias a investigaciones como las que antes he relatado, podemos hoy disfrutar y tener una vida cómoda y de inusitados medios a nuestro alcance para poder saber sobre el por qué de las cosas.
emilio silvera
Nov
24
Hablemos de cuerpos
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (0)
Comments (0)
Me referiré en primer lugar a los que constituyen nuestro entorno ordinario, que sería todo el entorno que abarca nuestro planeta. En segundo lugar considerare los demás cuerpos y objetos del Universo. El análisis de muestras de esos diversos cuerpos ha puesto de manifiesto que, en función de la composición, los cuerpos pueden ser simples y compuestos. Los primeros son, precisamente, los llamados elementos químicos, a las que el insigne Lavoisier (conocido como padre de la Química), consideró como el último término a que se llega mediante la aplicación del análisis químico.
Hoy sabemos que son colectividades de átomos isotópicos.
La mayoría de ellos son sólidos y se encuentran en la Naturaleza (nuestro entorno terráqueo) en estado libre o en combinación química con otros elementos, formando los diversos minerales.
La ordenación de los iones en las redes se manifiesta externamente en multitud de formas y colores. No obstante, debo señalar que, aun siendo abundante esta variedad, no es tan rica como la que corresponde a los cuerpos vivos, tanto animales como vegetales. La explicación se basa en que el número de especimenes moleculares y su complejidad son mucho mayores que en el reino inorgánico.
Sería conveniente, salir al paso de una posible interpretación errónea. Me refiero a que pudiera pensarse que los reinos que acabamos de mencionar constituyen clases disyuntas, esto es, sin conexión mutua. Y no lo digo porque esté considerando el hecho de que el carbono forma compuestos inorgánicos y orgánicos (lo que también hace el silicio), sino porque haya existido, y aún pueda existir, una conclusión, mejor conexión evolutiva del mundo inorgánico y el viviente que no se puede descartar, de hecho, yo particularmente, estoy seguro de ello. Estamos totalmente conectados con los ríos, las montañas y los valles, con la tierra que pisamos, el aire que respiramos y con todo el resto del Universo del que formamos parte.
La teoría de Cairos Swith considera que el eslabón entre ambos mundos se halla localizado en los microcristales de arcilla. Mi teoría particular es que no hay eslabón perdido en dicha conexión, sino que es el tiempo el que pone, en cada momento, una u otra materia en uno u otro lugar. Ahora, nos ha tocado estar aquí como ser complejo, pensante y sensitivo. El eón que viene nos puede colocar formando parte de un enorme árbol, de un monte, o, simplemente estar reposando como fina arena en el lecho de un río. Sin dudarlo, J.M.y P. formarán parte de un hermoso jardín perfumado y lleno de aromas que la brisa regalará a los que pasen cerca de allí.
El granito, por ejemplo, consiste básicamente en una mezcla de tres cuerpos compuestos: cuarzo, mica y feldespato. ¿Quién puede decir hoy lo que seremos mañana?
En todos los cuerpos que hemos estado considerando hasta ahora, las moléculas, los átomos o los iones se hallan situados en los nudos de la correspondiente red, así que, los electrones de esos individuos se encuentran también localizados en el entorno inmediato de esos lugares. Podríamos decir que la densidad electrónica es una función periódica espacial, lo que significa que al recorrer la red siguiendo una determinada dirección irían apareciendo altibajos, es decir, crestas y valles de la densidad electrónica.
La estructura de los cuerpos metálicos, así como las aleaciones, merecen una consideración especial. La estructura de los metales y aleaciones difiere de la de los demás cuerpos en un aspecto muy importante que consideraré a continuación.
Me refiero a que en los cuerpos metálicos existe una deslocalización de los electrones que están menos fuertemente enlazados en los correspondientes núcleos, es decir, de los electrones de valencia.
Vamos a precisar un poco. Supongamos, para fijar las ideas, que tenemos un trozo de plata metálica pura. En los nudos de la red correspondientes los átomos han perdido su electrón de valencia, pero ocurre que cada uno de estos electrones forma una colectividad que se halla desparramada o dispersa por todo el sólido. Una primera imagen de esta situación fue establecida por el gran físico italiano Enrico Fermi, por lo que se habla de un gas electrónico, llamado también de Fermi, que llenaría los espacios libres, es decir, no ocupados por los iones metálicos.
Este gas electrónico es el responsable de las propiedades metálicas, tales como el brillo, conductibilidades eléctrica y térmica, etc. La aplicación de la mecánica cuántica a la descripción del estado metálico conduce a la obtención del mapa de la densidad electrónica, o, como decía antes, a las características de la información correspondiente.
Sin entrar en detalles que desviarían nuestra atención hacia otros conceptos fuera de los límites de lo que ahora estoy pretendiendo, utilizaré el mismo lenguaje que para las estructuras de núcleos y átomos.
Recordemos que en la sociedad de los nucleones y electrones existen las relaciones verticales y las de estratificación, que se manifiestan en las capas y subcapas. En el caso de los metales tendríamos una colectividad de núcleos, arropados con sus capas cerradas, ocupando los nudos de la red; únicamente los electrones de valencia de cada átomo forman la colectividad del gas electrónico.
La pregunta que nos debemos hacer es: ¿estos electrones, en número igual, por lo menos, al de los átomos, se hallan estratificados? La respuesta es que sí. Existe una estratificación de estos electrones en las llamadas bandas. El concepto de banda energética resulta de la consideración simultánea de dos aspectos: la cuantización energética ( o la estratificación de los niveles energéticos en los átomos) y el grandísimo número de electrones existentes. Este colectivo no podría ubicarse en un número finito y escaso de niveles. Esta dificultad queda soslayada si se admite que cada uno de esos niveles atómicos de los N átomos que forman el cuerpo se funde en otros tantos niveles de cierta anchura donde ya pueden alojarse los electrones disponibles.
Esa fusión de los niveles atómicos da lugar a las bandas. Esta imagen equivaldría a considerar un metal como un átomo gigante en el que los niveles energéticos poseyeran una anchura finita.
En cuanto a la información que puede soportar un metal, podríamos señalar que sería parecida a la del correspondiente átomo, pero mucha más extendida espacialmente. Una información puntual, la del átomo, daría paso a otra espacial, si bien vendría a ser una mera repetición periódica de aquella.
¿Y los cuerpos que pueblan el resto del Universo?
Cuando un cuerpo sobrepasa unas determinadas dimensiones, aparece algo que conocemos como fuerza gravitatoria y que se deja sentir en la forma que todos conocemos y, que da lugar, primeramente a la fusión de los diversos materiales que forman los cuerpos.
Así, por ejemplo, en el cuerpo que llamamos Tierra, la presión crece con la profundidad, por lo que, a partir de un determinado valor de ésta, aparece el estado líquido y con él una estratificación que trata de establecer el equilibrio hidrostático.
Dentro de nuestro sistema planetario se distinguen los planetas rocosos, hasta Marte y meteoritos inclusive, y el resto de ellos, desde Júpiter en adelante, incluido este. Estos últimos difieren esencialmente de los primeros en su composición. Recuérdese que la de Júpiter es mucho más simple que la de los planetas rocosos. Consta fundamentalmente de hidrógeno, helio, agua, amoniaco y metano, con un núcleo rocoso en su interior. El hidrógeno que rodea a este núcleo se encuentra en forma de hidrógeno atómico sólido*
También la composición del Sol (y todas las estrellas que brillan) es más simple que la de los planetas rocosos, su estado físico es el de plasma y su contenido está reducido (mayormente) a hidrógeno y helio. Mas variedad de materiales existe en las estrellas supernovas, donde el primitivo hidrógeno ha evolucionado de la manera que expliqué en otra parte de este trabajo.
En cuanto a los derechos de la evolución estelar, enanas blancas, estrellas de neutrones y agujeros negros, señalaré que la composición de la primera es sencilla en cuanto al numero de “elementos” constituyentes; la segunda ya lo indica su propio nombre, constan de nucleones, particularmente neutrones que están fuertemente empaquetados (muy juntos) por la gravedad. Una estrella de nuetrones puede tener una densidad superior a la del agua, en millones de veces y del mismo orden que la de los núcleos atómicos. El agujero negro, es un fenómeno aparte, su inmensa fuerza gravitatoria es tal que, ni la luz puede escapar de ella, es decir, su velocidad de escape es superior a 300.000 km/s, y, como según la relatividad, nada es en nuestro Universo, superior en velocidad, a la luz, resulta que nada podrá escapar de un agujero negro.
Allí dentro, en el interior del agujero negro, no existen ni el tiempo ni el espacio, es como un objeto que estando en nuestro Universo (deja sentir su fuerza gravitatoria y engulle estrellas), al mismo tiempo, no está aquí.
Desde el comienzo de este trabajo estoy tratando de relacionar el Universo, la materia y la consciencia, es por ello que me he entrenido en dar tantas explicaciones que, para no resultar pesado, he amenizado con alguna que otra historia, noticia o comentario.
Ha sido un largo recorrido por las profundidades de la materia vista desde distintas perspectivas, y, en ella, estamos nosotros incluidos, con una adicional: El pensamiento, la racionalidad: el Ser.
emilio silvera
En todo el Universo, siempre es lo mismo, rigen las mismas leyes, las mismas fuerzas y está presente la misma materia.
| QuarksNucleones
Núcleos Átomos Moléculas Sustancias Cuerpos Planetas ( Vida ) Estrellas Galaxias Cúmulos de Galaxias UNIVERSO
|
Oct
18
Átomos, Isótopos, Química, Elementos.
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (15)
Comments (15)
Un amigo profesor de Instituto me ha pedido que reponga este trabajo para que sus alumnos le lleven el pr´çoximo lunes un trabajo sobre él. Así que, no habiendo inconveniente alguno en ello, aquí queda expuesto para que los chicos tengan su base de trabajo.
———————–
Hacia 1.900 se sabía que el átomo no era una partícula simple e indivisible, como predijo Demócrito, pues contenía, al menos, un corpúsculo subatómico: el electrón, cuyo descubridor fue J. J. Thomson, el cual supuso que los electrones se arracimaban como uvas en el cuerpo principal del átomo de carga positiva.
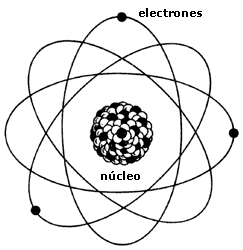
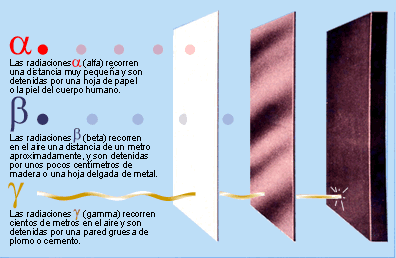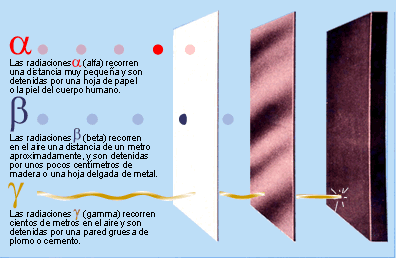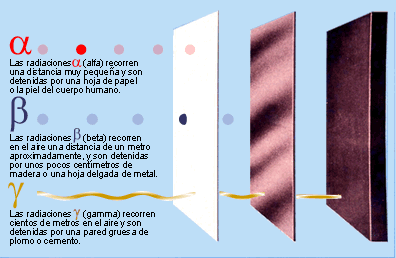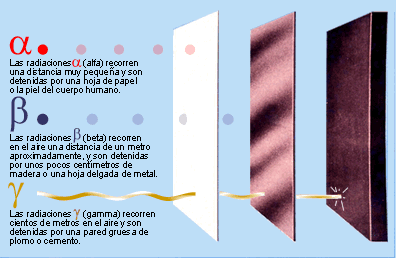
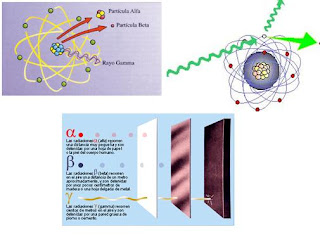
Poco tiempo después resultó evidente que existían otras subpartículas en el interior del átomo. Cuando Becquerel descubrió la radiactividad, identificó como emanaciones constituidas por electrones algunas de las radiaciones emitidas por sustancias radiactivas. Pero también quedaron al descubierto otras emisiones. Los Curie en Francia y Ernest Rutherford en Inglaterra detectaron una emisión bastante menos penetrante que el flujo electrónico. Rutherford la llamó rayos alfa, y denominó rayos beta a la emisión de electrones.

Los electrones volantes constitutivos de esta última radiación son, individualmente, partículas beta. Así mismo, se descubrió que los rayos alfa estaban formados por partículas, que fueron llamadas partículas alfa. Como ya sabemos, alfa y beta son las primeras letras del alfabeto griego y se escriben con los gráficos α y β.

Entretanto, el químico francés Paul Ulrico Villard descubría una tercera forma de emisión radiactiva, a la que dio el nombre de rayos gamma, es decir, la tercera letra del alfabeto griego (γ). Pronto se identificó como una radiación análoga a los rayos X, aunque de menor longitud de onda.
Jul
18
Átomos, sustancias, elementos, química…
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (3)
Comments (3)

Poco tiempo después resultó evidente que existían otras subpartículas en el interior del átomo. Cuando Becquerel descubrió la radiactividad, identificó como emanaciones constituidas por electrones algunas de las radiaciones emitidas por sustancias radiactivas. Pero también quedaron al descubierto otras emisiones. Los Curie en Francia y Ernest Rutherford en Inglaterra detectaron una emisión bastante menos penetrante que el flujo electrónico. Rutherford la llamó rayos alfa, y denominó rayos beta a la emisión de electrones.

Los electrones volantes constitutivos de esta última radiación son, individualmente, partículas beta. Así mismo, se descubrió que los rayos alfa estaban formados por partículas, que fueron llamadas partículas alfa. Como ya sabemos, alfa y beta son las primeras letras del alfabeto griego y se escriben con los gráficos α y β.

Entretanto, el químico francés Paul Ulrico Villard descubría una tercera forma de emisión radiactiva, a la que dio el nombre de rayos gamma, es decir, la tercera letra del alfabeto griego (γ). Pronto se identificó como una radiación análoga a los rayos X, aunque de menor longitud de onda.
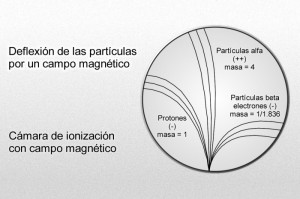
Mediante sus experimentos, Rutherford comprobó que un campo magnético desviaba las partículas alfa con mucho menos fuerza que las partículas beta. Por añadidura, las desviaba en dirección opuesta, lo cual significaba que la partícula alfa tenía una carga positiva, es decir, contraria a la negativa del electrón. La intensidad de tal desviación permitió calcular que la partícula alfa tenía como mínimo una masa dos veces mayor que la del hidrogenión, cuya carga positiva era la más pequeña conocida hasta entonces.

En 1.909, Rutherford pudo aislar las partículas alfa. Puso material radiactivo en un tubo de vidrio fino rodeado por vidrio grueso, e hizo el vacío entre ambas superficies. Las partículas alfa pudieron atravesar la pared fina, pero no la gruesa, lo que dio lugar a que las partículas quedaran aprisionadas entre ambas, y Rutherford recurrió entonces a la descarga eléctrica para excitar las partículas alfa, hasta llevarlas a la incandescencia. Entonces mostraron los rayos espectrales del helio.

Hay pruebas de que laspartículas alfa producidas por sustancias radiactivas en el suelo constituyen el origen del helio en los pozos de gas natural. Si la partícula alfa es helio, su masa debe ser cuatro veces mayor que la del hidrógeno. Ello significa que la carga positiva de éste último equivale a dos unidades, tomando como unidad la carga del hidrogenión.
Más tarde, Rutherford identificó otra partícula positiva en el átomo. A decir verdad, había sido detectada y reconocida ya muchos años antes. En 1.886, el físico alemán Eugen Goldstein, empleando un tubo catódico con un cátodo perforado, descubrió una nueva radiación que fluía por los orificios del cátodo en dirección opuesta a la de los rayos catódicos. La denominó rayos canales.

Part of Astronomy that study physical and chemical characteristics of heavenly bodies. Astrophysics is the most important part of Astronomy at the present time owing to advance of modern physics. Doppler- Fizeau´s effect, Zeeman´s effect, quantum theories and thermonuclear reactions applied to study of heavenly bodies have permitted to discover the solar magnetic field, study stellar radiations and their processes of nuclear fusion, and determine radial velocity of stars, etc. Electromagnetic radiation of heavenly bodies permits to make spectrum analysis of themselves, and they are the principal fountain of information in this part of Astronomy
En 1.902, esta radiación sirvió para detectar por vez primera el efecto Doppler-Fizeau respecto a las ondas luminosas de origen terrestre. El físico alemán de nombre Johannes Stara orientó un espectroscopio de tal forma que los rayos cayeron sobre éste, revelando la desviación hacia el violeta. Por estos trabajos se le otorgó el premio Nobel de Física en 1.919.
Puesto que los rayos canales se mueven en dirección opuesta a los rayos catódicos de carga negativa, Thomson propuso que se diera a esta radiación el nombre de rayos positivos. Entonces se comprobó que las partículas de rayos positivos podían atravesar fácilmente la materia. De aquí que fuesen considerados, por su volumen, mucho más pequeños que los iones corrientes o átomos. La desviación determinada, en su caso, por un campo magnético, puso de relieve que la más ínfima de estas partículas tenía carga y masa similares a los del hidrogenión, suponiendo que este ión contuviese la misma unidad posible de carga positiva.
Por consiguiente se dedujo que la partícula del rayo positivo era la partícula positiva elemental, o sea, el elemento contrapuesto al electrón; Rutherford lo llamó protón (del neutro griego proton, “lo primero”).
Desde luego, el protón y el electrón llevan cargas eléctricas iguales, aunque opuestas; ahora bien, la masa del protón, referida al electrón, es 1.836 veces mayor (como señalo en el gráfico anterior).
Parecía probable pues que el átomo estuviese compuesto por protones y electrones, cuyas cargas se equilibraran entre sí. También parecía claro que los protones se hallaban en el interior del átomo y no se desprendían, como ocurría fácilmente con los electrones. Pero entonces se planteó el gran interrogante: ¿cuál era la estructura de esas partículas en el átomo?
El núcleo atómico

El propio Rutherford empezó a vislumbrar la respuesta. Entre 1.906 y 1.908 (hace ahora un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
En 1.908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.

Desde entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.

Con tres electrones, el litio es el elemento sólido más ligero
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de carga positiva en el núcleo atómico deben ser numéricamente idénticas a los electrones que contiene por norma, pues el átomo suele ser un cuerpo neutro, y esta igualdad de lo positivo con lo negativo es el equilibrio. De hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía el núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. Como es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.

Pero entre tanto se habían presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por número enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal, y ello dio lugar a una interesante historia.
Isótopos; construcción de bloques uniforme,
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.

Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.
Por entonces, Rutherford, a su vez, separó del torio un torio X muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que durante la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.
El material radiactivo llega a producir mutaciones.
Varios químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados. Entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
Hay que huir de los desechos radiactivos que causan la actividad del hombre
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907 los químicos americanos Herbert Newby McCoy y W. H. Ross descubrieron que el radiotorio (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio D, el mismo que el plomo, tanto que a veces era llamado radioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.

En 1.913, Soddy esclareció esta idea y le dio más amplitud. Demostró que cuando un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.

Soddy dio el nombre de isótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
El modelo protón–electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula alfa de un núcleo, se reducía en dos unidades la carga positiva de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!

¿Cómo se explica que cuando el torio se descompone en radiotorio después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta, y más tarde una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque en cierto modo, esto no afecta al resultado).
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía el número atómico 90, es decir, el mismo de antes.

El torio en estado natural
Así pues, el radiotorio, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de un átomo están sujetas al número de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o número másico. Así, el torio corriente se denomina torio 232, y el radiotorio, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones: plomo 210 (radio D), plomo 214 (radio B), plomo 212 (torio B) y plomo 211 (actinio B).

Se descubrió que la noción de isótopo podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206, la del torio en plomo 208 y la del actinio en plomo 207. cada uno de estos era un isótopo estable y corriente del plomo, pero los tres plomos diferían por su peso atómico.
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.

distintos isótopos
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.
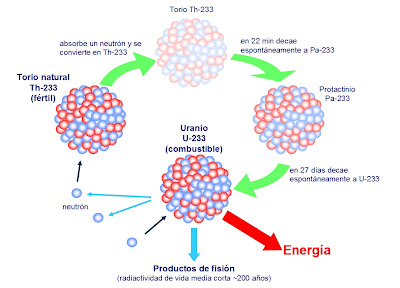
En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección; demostró que 993 de cada 1.000 átomos de uranio eran de uranio 238 (no válido para combustible nuclear). Y muy pronto se haría evidente el profundo significado de tal descubrimiento.

Sí, sólo el 7 por 1000 del uranio existente en la Tierra, es combustible nuclear, es decir, Uranio 235. El resto, es Uranio 238 que hay que reciclarlo en un Acelerador Generador para convertirlo en Plutonio 239 que nos sirva como combustible nuclaer de fisión.
Así, después de estar siguiendo huellas falsas durantes un siglo, se reivindicó definitivamente la teoría de Prout. Los elementos estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
emilio silvera
Feb
5
Conociendo la materia
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (1)
Comments (1)
Entre 1.906 y 1.908 (hace ahora un siglo) Rutherford realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol). Pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido.
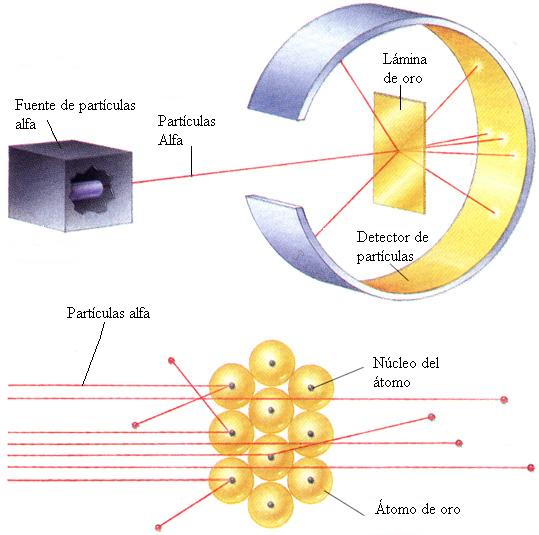
Rutherford supuso que aquellas “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad, desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo.)

En 1908 se concedió a Rutherfor el premio Nóbel de Química, por su extraordinaria labor de investigación sobre la naturaleza de la materia. El fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden descubrir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón -es decir, una partícula subatómica-, lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.

Átomo de Helio

El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ion. Y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
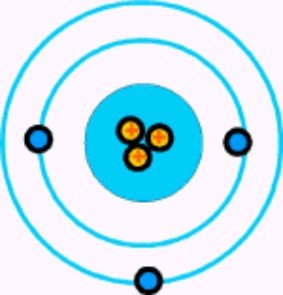
Átomo de Litio
Las unidades de una carga positiva en el núcleo atómico deben ser numéricamente idéntica a los electrones que contiene como norma, pues el átomo suele ser un cuerpo neutro y esta igualdad de lo positivo con lo negativo, es el equilibrio. Y, de hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero, en cambio, se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero, como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

Átomo de Uranio
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía del núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable, neutralizaba dos unidades de su carga. Como es natural, se pensó también –en el electrón-. Se podría componer el rompecabezas si se suponía que el núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva.
El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta) reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que, por caminos indirectos, llegó una respuesta mejor, como resultado de otras investigaciones.
Casi todo espacio vacío
Pero entretanto se había presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por números enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo del hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón. Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal. Y ello dio lugar a una interesante historia.
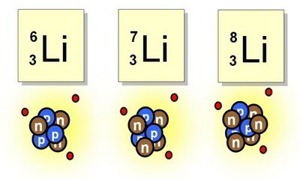
ÍSOTOPOS
Construcción de bloques uniformes
Allá por 1816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía de entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado a 16). El cloro (según dije antes) tiene un peso atómico aproximado de 35’5, o para ser exactos, de 35’457. Otros ejemplos son el antimonio, con un peso atómico de 121’75; el bario, con 127’34; el boro, con 10’811, y el cadmio, con 112’40.

Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del “tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.
Por entonces, Rutherfor, a su vez, separó del torio un “torio X” muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.

Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.

Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radiotorio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos, y así sucesivamente.
En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radiotorio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.

Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1921 se le concedió el premio Nóbel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.

¿Cómo se explica que cuando el torio se descompone en “radiotorio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)

El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radiotorio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radiotorio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).

Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”
Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.

En las explotaciones a cielo abierto se hacen voladuras controladas para remover las rocas, que posteriormente son transportadas hacia la planta de trituración en vehículos. En este proceso se libera polvo tóxico a la atmósfera, además de gas radón producto de la desintegración radioactiva. Otro foco de contaminación asociado a este tipo de minería es que, debido a los procesos de tratamiento del mineral, se generan como residuos elementos como radio, torio, uranio empobrecido, metales pesados en lodos junto con el uranio, etc., que se pueden incorporar a las aguas tanto en superficie como subterráneas. Además, los elementos radioactivos se desintegran de forma espontánea con la emisión de partículas alfa, beta y gamma.
Lo cierto es que, jugamos con fuerzas que no sabemos controlar y de las que, ni pensamos en las consecuencias que nos puedan traer. Bueno, saberlo si lo sabemos pero cerramos los ojos, dado que el beneficio de tales negocios “bien valen algunos daños coñaterañes”…
Sin comentario a este último pensamiento.
emilio silvera
















 Totales: 67.464.779
Totales: 67.464.779 Conectados: 35
Conectados: 35
























