Feb
5
Conociendo la materia
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (1)
Comments (1)
Entre 1.906 y 1.908 (hace ahora un siglo) Rutherford realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol). Pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido.
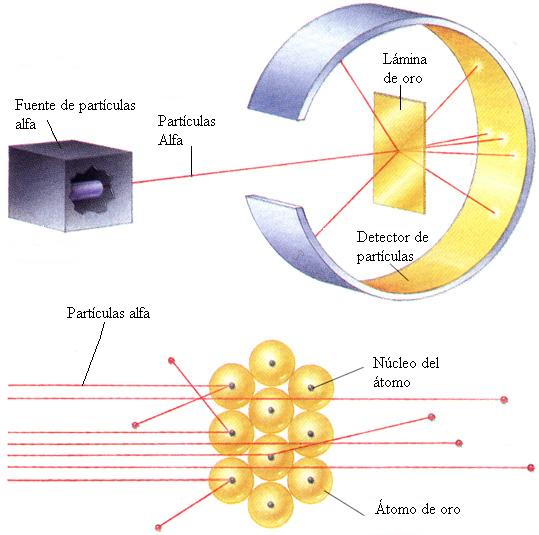
Rutherford supuso que aquellas “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad, desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo.)

En 1908 se concedió a Rutherfor el premio Nóbel de Química, por su extraordinaria labor de investigación sobre la naturaleza de la materia. El fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden descubrir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón -es decir, una partícula subatómica-, lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.

Átomo de Helio

El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ion. Y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
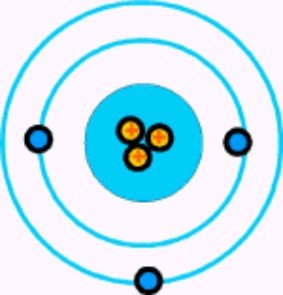
Átomo de Litio
Las unidades de una carga positiva en el núcleo atómico deben ser numéricamente idéntica a los electrones que contiene como norma, pues el átomo suele ser un cuerpo neutro y esta igualdad de lo positivo con lo negativo, es el equilibrio. Y, de hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero, en cambio, se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero, como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

Átomo de Uranio
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía del núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable, neutralizaba dos unidades de su carga. Como es natural, se pensó también –en el electrón-. Se podría componer el rompecabezas si se suponía que el núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva.
El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta) reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que, por caminos indirectos, llegó una respuesta mejor, como resultado de otras investigaciones.
Casi todo espacio vacío
Pero entretanto se había presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por números enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo del hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón. Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal. Y ello dio lugar a una interesante historia.
ÍSOTOPOS
Construcción de bloques uniformes
Allá por 1816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía de entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado a 16). El cloro (según dije antes) tiene un peso atómico aproximado de 35’5, o para ser exactos, de 35’457. Otros ejemplos son el antimonio, con un peso atómico de 121’75; el bario, con 127’34; el boro, con 10’811, y el cadmio, con 112’40.

Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del “tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.
Por entonces, Rutherfor, a su vez, separó del torio un “torio X” muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.

Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.

Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radiotorio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos, y así sucesivamente.
En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radiotorio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.

Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1921 se le concedió el premio Nóbel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.

¿Cómo se explica que cuando el torio se descompone en “radiotorio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)

El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radiotorio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radiotorio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).
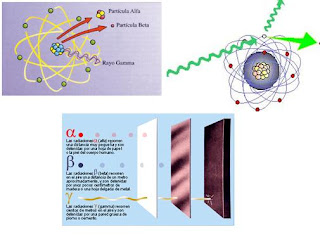
Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”
Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.

En las explotaciones a cielo abierto se hacen voladuras controladas para remover las rocas, que posteriormente son transportadas hacia la planta de trituración en vehículos. En este proceso se libera polvo tóxico a la atmósfera, además de gas radón producto de la desintegración radioactiva. Otro foco de contaminación asociado a este tipo de minería es que, debido a los procesos de tratamiento del mineral, se generan como residuos elementos como radio, torio, uranio empobrecido, metales pesados en lodos junto con el uranio, etc., que se pueden incorporar a las aguas tanto en superficie como subterráneas. Además, los elementos radioactivos se desintegran de forma espontánea con la emisión de partículas alfa, beta y gamma.
Lo cierto es que, jugamos con fuerzas que no sabemos controlar y de las que, ni pensamos en las consecuencias que nos puedan traer. Bueno, saberlo si lo sabemos pero cerramos los ojos, dado que el beneficio de tales negocios “bien valen algunos daños coñaterañes”…
Sin comentario a este último pensamiento.
emilio silvera
Feb
3
El asombroso Universo: No sabemos todo lo que contiene
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El Universo asombroso ~
Clasificado en El Universo asombroso ~
 Comments (1)
Comments (1)
Hoy, con los conocimientos que atesoramos y los sofisticados instrumentos con los que contamos y, con los avances que hemos podido conseguir en Física y Astrofísica, hemos llegado a un nivel muy aceptable del conocimiento de las estrellas y del proceso que siguen desde que nacen hasta que mueren, y, de entre toda la variedad de estos objetos estelares, los que más han llamado la atención por sus especiales caracterísiticas, han sido esas estrellas que, al final de sus vidas y dependiendo de sus masas, se pueden convertir en:
- Enanas Blancas,
- Estrellas de Neutrones,
- ¿Estrellas de Quarks-Gluones?, y
- Agujeros Negros.

De todas ellas podemos (más o menos) explicar sus más destacadas caracteristicas y también el por qué, a partir de una estrella, se convierten en esos extraños objetos de tan altas densidades y, cada una de ellas (la estrella enana blanca, la de neutrones o el agujero negro, tienen sus especiales peculiaridades) pero, siguiendo la secuencia de estos tres ejemplos, la pregunta que se plantea es:
¿Podrán existir las Estrellas de Quarks? Bueno…
Colisión de iones pesados registrada por el experimento ALICE. (Imagen: CERN.) El acelerador europeo ha obtenido plasma de quarks–gluones, el primer estado de la materia tras el Big Bang. Parece que todo lo que podamos imaginar, va siendo posible y, aunque no las hemos obervado “todavía”, no me extrañaría nada que, las estrellas de Quarks, estuvieran presentes en el Universo.
No todo son bosones de Higgs en las instalaciones del CERN. Aún hay muchas preguntas sobre el universo y sus partículas que se pueden responder a base de colisiones de alta energía. Y en eso, el LHC es el mejor. Un grupo de investigadores del consorcio europeo ha realizado nuevas mediciones de la que creen que es el primer tipo de materia que hubo durante los instantes iniciales del universo. El plasma de quarks–gluones.
Los quarks y los gluones son, respectivamente, los ladrillos y el cemento de la materia ordinaria. Durante los primeros momentos tras el Big Bang, sin embargo, no estaban unidos constituyendo partículas —como protones o neutrones— sino que se movían libremente en estado de plasma. A base de colisionar iones de plomo —que es un átomo muy pesado— a velocidades cercanas a las de la luz, el LHC pudo recrear durante pequeños lapsos de tiempo las que se creen fueron las condiciones de los primeros momentos del universo.
El plasma de quarks–gluones es extremo y efímero. Por eso los investigadores han tenido que analizar los resultados de más de mil millones de colisiones para obtener resultados significativos.

Evento de colisión de 7 TeV visto por el detector LHCb. El experimento del LHCb en el LHC estará bien ubicado para explorar el misterio de la antimateria. Ya sabéis que, durante muchos años, la ausencia de antimateria en el Universo ha atormentado a los físicos de partículas y a los cosmólogos: mientras que el Big Bang debería haber creado cantidades iguales de materia y antimateria, no observamos ninguna antimateria primordial hoy en día. ¿Dónde ha ido? Los experimentos del LHC tienen el potencial de dar a conocer los procesos naturales que podrían ser la clave para resolver esta paradoja.
Cada vez que la materia es creada a partir de energía pura, se genera la misma cantidad de partículas y antipartículas. Por el contrario, cuando la materia y la antimateria se encuentran, se aniquilan mutuamente y producen luz. La antimateria se produce habitualmente cuando los rayos cósmicos chocan contra la atmósfera de la Tierra, y la aniquilación de materia y antimateria se observa durante los experimentos de física en los aceleradores de partículas.

Equipos de físicos en todo el mundo siguen analizando datos. Aquellas primeras colisiones de protones a la alta energía prevista de 7 TeV, una potencia jamás alcanzada en ningún acelerador antes, nos puede traer noticias largamente esperadas y desvelar misterios, contestar a preguntas planteadas y, en definitiva, decirnos cómo es la Naturaleza allí, donde el ojo humano no puede llegar pero…, si la inteligencia.
Lo cierto es que, todos tenemos que convenir en el hecho cierto de que, el LHC es el mayor experimento físico de la historia de la Ciencia y que, de seguro, nos dará la oportunidad de comprender muchas cuestiones que antes se nos aparecían oscuras e indistinguibles entre la bruma de esa lejanía infinitesimal de la cuántica. Ahora, tenemos una herramienta capaz de llevarnos hasta aquellos primeros momentos en los que se construyó la historia del universo y, si podemos, de esta manera “estar allí”, veremos, con nuestros propios ojos lo que pasó y por qué pasó de esa manera.
Toda esta larga exposición de temas -que venimos tratando aquí-, de alguna manera conectados,puede que añgún día, nos lleve hasta ese nivel esperado en el que, consigamos muchos más beneficios para toda la Humanidad. Pero como siempre, me desvío del tema.

La Hipótesis de estrella de Quarks (EQs) podrían responder a muchos interrogantes surgidos a partir de observaciones astrofísicas que no coinciden con los modelos canónicos teóricos de las Estrellas de Neutrones ( ENs ). Decimos que son hipotéticas porque se conjetura que estarían formadas por Materia Extraña ( ME ). La comunidad astrofísica espera evidencias observacionales que permitan diferenciarlas de las ENs, ya que podrían explicar un conjunto de observaciones astronómicas que aún resultan una incógnita. Es sabido que una EN es el remanente del colapso de una estrella masiva. El colapso de la estrella, la supernova, da lugar a un núcleo compacto hiperdenso de hierro y otros metales pesados que sigue comprimiéndose y calentándose. Su densidad continúa aumentando, dando lugar a una “neutronización“ (recombinación de electrones con protones que resultan en neutrones) y el gas degenerado de neutrones frena el colapso del remanente.

Se especula con la posibilidad de que existan estrellas de Quarks que estarían hechas de materia extraña de Quaks y Gluones
Una EQ, a diferencia de una EN, no se originaría necesariamente de una evolución estelar después del agotamiento del combustible nuclear de una estrella normal. Sería, probablemente, producto de la transición de fase hadrón-quark a altísima densidad. La Cromodinámica Cuántica (CDC), la Teoría de las Interacciones Fuertes que ocurren dentro de los nucleones (protones y neutrones), concibe teóricamente la idea de la transición de fase hadrón-quark a temperaturas y/ o densidades extremadamente altas con el consecuente desconfinamiento de quarks y gluones, que formarían una especie de “sopa “. Sin embargo, los quarks libres no se han encontrado aún, en uno u otro límite, en ningún experimento terrestre.

La “sopa“ que mencionamos antes, se conoce como Plasma Quark-Gluón ( PQG ). En el límite de altas temperaturas, el PQG está tratandose de obtenerse en el laboratorio y existen fuertes indicios de que se logre con éxito experimentos de altas energías como el Colisionador Relativista de Iones Pesados (conocido por sus siglas en ingles como RHIC) de Brookhaven, New York. (De hecho, como más arriba queda reflejado, ya se ha conseguido).
Por otro lado, se espera que a través de observaciones astronómicas se compruebe que la transición a altas densidades se hubiese producido en el interior de alguna EN. Esto se debe a que los valores de densidades estimados para que dicha transición tuviese lugar coinciden con densidades del orden de 3-12 ρ0 (siendo ρ0 ̃ 0, 17 fm y ˉ ³ la densidad de equilibrio nuclear) que son típicas del interior de las ENs. Los cálculos basados en diferentes ecuaciones de estado de la materia nuclear muestran estos resultados, por lo que sería razonable que el núcleo de las ENs estuviese formado por materia de quarks.

De existir, al ser más densa, la estrella de Quarks estaria entre la de N y el A.N.
Recientemente, la relación entre campo magnéticos y materia densa está atrayendo la atención de los astrofísicos, especialmente después de las observaciones de emisiones peculiares de pulsares anómalos de rayos X, que se interpretan como ENs en rotación, y de emisiones de radiación γ de baja energía de los llamados repetidores de rayos γ suaves ( SGRs – soƒt gamma-ray repeaters ). El motor central de esas radiaciones podría ser un campo magnético mayor que 4 x 10¹³ Gauss, que es el campo crítico previsto por la Electrodinámica Cuántica.
Muchas observaciones astronómicas indirectas sólo se explicarían a través de la existencia de campos magnéticos muy intensos en los núcleos de ENs en EQs, de manera que el papel que juega el campo magnético en la ME aún constituye un problema abierto y de sumo interés en la Astrofísica.

Son muchos los misterios quen contiene el Universo y, nosotros, debemos recorrer los caminos para desvelarlos. En la superconductividad electromagnética usual, un campo magnético suficientemente fuerte destruye el estado superconductor. Para la superconductividad de color no existe aún un consenso de cómo, la presencia del campo magnético, podría afectar al apareamiento entre los quarks.
Existen trabajos que describen de manera breve la materia extraña, con el objetivo de explicar su formación en el interior de una EN y entender la composición y características de una EQ. Han utilizado el modelo fenomenológico de bag del Massachussets Institute of Technology (MIT) para encontrar las ecuaciones de estado de la ME en condiciones determinadas, comprobando la estabilidad de la misma, frente a la materia de quarks ordinaria formada sólo por quarks u y d. Y piensan presentar, además, algunas candidatas posibles a EQs según observaciones astrofísicas. Por último, trataran de entender la superconductividad de color y la influencia del campo magnético intenso en las fases superconductoras.

Materia de Quarks:
Uno de los mayores logros alcanzados por los físicos en el último siglo, fue la construcción del Modelo Estándar en la física de partículas elementales. Este modelo sostiene que la materia en el Universo está compuesta por fermiones, divididos en quarks y leptones, que interactúan a través de los llamados bosones de calibre: el fotón (interacción electromagnética), los bosones W± y Zº (interacción débil), y 8 tipos de gluones (interacción fuerte). Junto con los bosones de calibre, existen tres generaciones de fermiones: ( v e, e ), u, d ); ( vµ, µ ), ( c, s ) ; ( v….); y sus respectivas antipartículas. Cada “ sabor “ de los quarks, up ( u ), down ( d ), charme ( c ), strange ( s , top ( t ) y bottom ( b), tiene tres colores ( el color y el sabor son números cuánticos ). La partícula que aún no ha sido descubierta experimentalmente es el bosón de Higgs, que cabe suponer sería responsable del origen de la masa de las partículas.
Los quarks son los componentes fundamentales tanto de los hadrones fermiónicos (bariones formados por la combinación de tres quarks) como de los bosónicos (mesones formados por un quark y un antiquark). ES sabido que el núcleo de un átomo está compuesto por nucleones (protones y neutrones) que a su vez están compuestos por quarks (protón = udd). David Gross y Franks Wilczek y David Politzer, descubrieron teóricamente que en la CDC el acoplamiento efectivo entre los quarks disminuye a medida que la energía entre ellos aumenta (libertad asintótica). La elaboración de esta teoría permitió que recibieran el Premio Nobel de Física en el año 2004. En los años 60, la libertad asintótica fue comprobada experimentalmente en el Acelerador lineal de Stanford.

Podemos imaginar a los Quarks, confinados dentro de los protones y neutrones nadando en una sopa de Gluones.
Sin embargo, la CDC no describe completamente el deconfinamiento en un régimen de alta densidad y baja temperatura, debido a su complejidad matemática y a su naturaleza no lineal para bajas energías. No obstante, es posible recurrir a una descripción fenomenológica para intentar entender la física de la formación de la materia de quarks en las ENs. La materia de quarks, es decir, el plasma de quarks deconfinados y gluones, es una consecuencia directa de la libertad asintótica cuando la densidad bariónica o la temperatura son suficientemente altas como para considerar que los quarks son partículas más fundamentales que los neutrones o protones. Esta materia, entonces, dependiendo de la temperatura y del potencial químico (µ) de los quarks, aparecería esencialmente en dos regímenes. Uno de ellos, el PQG, constituiría la fase “caliente” de la materia de quarks cuando T >> µ constituyendo la mencionada ME, que se formaría en el interior de las Ens. Esta transición de fase estaría ocurriendo en el Universo cada vez que una estrella masiva explotara en forma de supernova, con la consecuente aparición de una EN.

El observatorio Chandra de rayos X de la NASA también encontró dos estrellas inusuales: la fuente RX J1856.5-3754 con una temperatura de 105 K y la fuente 3C58 con un período de 65 ms. RX J1856.5-3754 es demasiado pequeña para ser una EN convencional y 3C58 parece haberse enfriado demasiado rápido en el tiempo de vida que se le estima.
Combinando los datos del Chandra y del telescopio espacial Hubble, los astrónomos determinaron que RX J1856. 5 – 3754 radia como si fuera un cuerpo sólido con una temperatura de unos 1x 10 exp5. ºC y que tiene un diámetro de alrededor de 11 km, que es un tamaño demasiado pequeño como para conciliarlo con los modelos conocidos de las Ens.
Las observaciones realizadas por el Chandra sobre 3C58 también produjeron resultados sorprendentes. No se pudo detectar la radiación que se esperaba en la superficie de 3C58, una EN que se cree producto de la explosión de una supernova vista por astrónomos japoneses y chinos en el año 1181 de nuestra era. Se llegó a la conclusión de que la temperatura de la estrella, de menos de un millón de grados Celsius, era un valor mucho menor que el que predice el modelo. Estas observaciones incrementan la posibilidad de que los objetos estelares mencionados sean verdaderas ¡Estrellas de Quarks!
A mí, no me sorprendería nada.
emilio silvera
Feb
3
La necesidad agudiza la imaginación
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El saber del mundo ~
Clasificado en El saber del mundo ~
 Comments (7)
Comments (7)
La fuerza nuclear débil nos habla de materiales que, de manera natural, emiten radiación y se desintegran. Al pensar en la desintegración me ha traído a la memoria aquellos libros de Asimov que nos explicaba cuestiones de ciencia y nos decía existen materiales que también se desintegran de manera natural y que son materiales fértiles, o que sin serlo, se pueden transformar en otros que sí lo son.
Al hablar de material fértil me estoy refiriendo a núclidos que pueden absorber neutrones para formar material fisible. El uranio-238, por ejemplo, absorbe un neutrón para formar uranio-239, que se desintegra en plutonio-239. Este es el tipo de conversión que la imaginación del hombre hace que ocurra en un reactor reproductor.

Lo explicaré con más detalles: El Reactor Reproductor Rápido es un reactor de neutrones rápidos diseñado para producir combustible generando más material fisible del que consume. El FBR es uno de los tipos posibles de reactores reproductores.
Veámos: El uranio-235 es un combustible práctico, es decir, los neutrones lentos son capaces de hacer que el uranio-235 se fisione, o lo que es lo mismo, se rompan sus átomos en dos, produciendo neutrones lentos, que a su vez inducen otras fisiones atómicas. El uranio-233 y el plutonio-239 son también combustibles nucleares prácticos por las mismas razones.
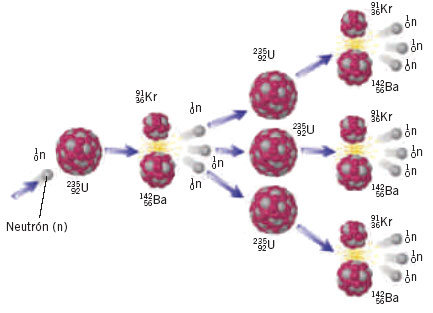
Desgraciadamente, el uranio-233 y el plutonio-239 no existen en estado natural sino en trazas mínimas, y el uranio-235, aunque existe en cantidades apreciables, no deja de ser raro. En cualquier muestra de uranio natural, sólo siete de cada mil átomos son de uranio-235, el resto es uranio-238.

Uranio
El uranio natural extraído de las minas contiene un 99´3 % de U-238 y apenas el 0´7 % de U-235.
El uranio-238, la variedad común de uranio, no es un combustible nuclear práctico. Así que, el uranio que más abunda en la naturaleza no sirve como combustible nuclear. Podemos conseguir que se fisione, pero sólo con neutrones rápidos. Los átomos de uranio-238 que se rompen en dos, producen neutrones lentos, que no bastan para producir o inducir nuevas fisiones. El uranio-238 cabría compararlo a la madera húmeda: es posible hacer que arda, pero acabará por apagarse.

El uranio es un elemento químico metálico de color plateado-grisáceo de la serie de los actínidos, su símbolo químico es U y su número atómico es 92. Por ello posee 92 protones y 92 electrones, con una valencia de 6. Su núcleo puede contener entre 142 y 146 neutrones, sus isótopos más abundantes son el 238U que posee 146 neutrones y el 235U con 143 neutrones. El uranio tiene el mayor peso atómico de entre todos los elementos que se encuentran en la naturaleza. El uranio es aproximadamente un 70% más denso que el plomo, aunque menos denso que el oro o el wolframio. Es levemente radioactivo. Fue descubierto como óxido en 1789 por M. H. Klaproth que lo llamó así en el honor del planeta Urano que acababa de ser descubierto en 1781.
Supongamos, sin embargo, que se separa el uranio-235 del uranio-238 (trabajo más bien difícil) y que se utiliza aquel para hacer funcionar un reactor nuclear. Los átomos de uranio-235 que forman el combustible del reactor se fisionan y esparcen miríadas de neutrones lentos en todas direcciones. Si el reactor está rodeado por una capa de uranio ordinario (que en su mayor parte es uranio-238), los neutrones que van a parar allí son absorbidos por el uranio-238 y, aunque no pueden hacer que el uranio-238 se fisione, sí pueden provocar otros cambios que finalmente, producirán plutonio-239. Separando este plutonio-239 del uranio (tarea muy fácil), puede ser utilizado como combustible nuclear practico para la fisión.
De esta manera, el reactor nuclear genera nuevo combustible a partir de un material (uranio-238) que no lo es. Este es el motivo de que al reactor nuclear que hace posible la transformación se le llame “reactor generador”.
Un reactor generador bien diseñado puede producir más plutonio-239 que el uranio-234 consumido para ello. De este modo, las reservas totales de uranio de la Tierra (y no sólo las de uranio-235) se convierten en potenciales de combustible nuclear.

Torio
Carlo Rubbia, exdirector del CERN (los mismos que hicieron el Colisionador de Hadrones) y ganador del premio Nobel de física en 1984, ha trabajado buena parte de su carrera en el desarrollo de tecnologías para la producción de energía a partir de torio y calcula que con un reactor adecuado, este proceso de fisión podría generar a partir de 1 tonelada del elemento la misma cantidad de energía que 200 toneladas de uranio y 3.500.000 toneladas de carbón.
El torio, tal como se da en la naturaleza, consiste todo él en torio-232, que al igual que el uranio-238, no es un combustible nuclear práctico, porque requiere neutrones rápidos para fisionarse. Pero si se coloca torio-232 alrededor de un reactor nuclear, sus átomos absorberán los neutrones y, sin experimentar fisión alguna, se convertirán en átomos de uranio-233. Como el uranio-233 es un combustible práctico que se puede separar fácilmente del torio, el resultado es otra variedad del reactor generador, que convierte las reservas de torio en un combustible nuclear en potencia.


Hasta que no se descubra otra manera de producir energía, el Uranio seguirá
La cantidad total de uranio y de torio que hay en la Tierra es unas 800 veces mayor que las reservas de uranio-235, lo que significa que el buen uso de los reactores generadores podría multiplicar por 800 la oferta potencial de energía extraída de plantas de fisión nuclear.
En este punto, sin dejar de elogiar la inteligencia del hombre que ha sabido encontrar la manera de transformar una materia inservible en otra practica, hay que decir que la energía de fisión nuclear genera también muchos problemas.
Como estará comprobando al lector de este trabajo, el autor ha querido esta vez diversificar los temas y plasmar una variedad múltiple que facilite el conocimiento de distintas cosas que ocurren en la naturaleza, o que la mano del hombre hace que ocurran, y todas estas cuestiones tratadas aquí van encaminadas a resolver preguntas que en alguna ocasión nos hemos podido hacer, tales como:
¿Por qué al calentar un metal se pone primero rojo, luego naranja, después amarillo, pero a continuación blanco en lugar de seguir el espectro y ponerse verde?
¿Y el color en las estrellas?
Cuando un herrero está trabajando, el metal adquiere diferentes colores según recibe el calor de la fragua. Primero se mostrará de un rojo intenso, para ir progresivamente adoptando tonos más claros, pasando del anaranjado al amarillo, y por fin al blanco.
Si se pudiera seguir calentando el hierro, éste adquiriría tonos azulados. Estos cambios en la coloración son una consecuencia directa del aumento de la temperatura, que permitirá mayor maleabilidad. El Cúmulo del Joyero (en la constelación de la Cruz del Sur), fotografiado arriba, muestra cómo ocurre lo mismo con las estrellas, de manera que encontraremos estrellas azules, las más calientes, blancas, amarillas, anaranjadas y rojas, las más “frías”. A veces, estos colores pueden percibirse a simple vista, como Antares (Alpha Scorpii) que es de color rojo, o Rigel (Beta Orionis) blanco-azulada.
En la Naturaleza rigen las mismas leyes para todos y, en todas partes se producen los mismos fenómenos debidos a las mismas causas, en este caso: ¡La Temperatura!
Cualquier objeto, a cualquier energía superior al cero absoluto, radia ondas electromagnéticas. Si su temperatura es muy baja, emite sólo ondas de radio largas, muy pobres en energías. Al aumentar la temperatura, radia una cantidad mayor de ondas, pero también empieza a radiar ondas de radio más cortas (y más energéticas). Si la temperatura sigue subiendo, empiezan a radiarse microondas aún más energéticas y después radiaciones infrarrojas.

Esto no quiere decir que a una temperatura dada sólo se emitan ondas de radio largas, un poco más arriba sólo ondas de radio cortas, luego sólo microondas y después sólo infrarrojos. En realidad, se emite toda la gama de radiaciones, pero siempre hay una radiación máxima, es decir, una gama de longitudes de onda que son las más radiadas, flanqueadas por cantidades menores en el lado de las energías bajas y por cantidades todavía más pequeñas en el de las altas.
Cuando un objeto alcanza la temperatura del cuerpo humano (37°C), el máximo de radiación se encuentra en los infrarrojos largos. El cuerpo humano también radia ondas de radio, pero las longitudes de ondas más cortas y más energéticas son siempre las más fáciles de detectar por ser los más potentes.

Cuando la temperatura alcanza aproximadamente los 600°C, el máximo de radiación se halla en el infrarrojo corto. Pero a estas alturas la pequeña cantidad de radiación que se halla en el lado de las energías altas adquiere una importancia especial, porque entra ya en la región de la luz visible roja. El objeto reluce entonces con un rojo intenso.
Este rojo constituye sólo un pequeño porcentaje de la radiación total, pero como da la casualidad de que nuestro ojo lo percibe, le otorgamos toda nuestra atención y decimos que el objeto está al “rojo vivo”.
Si la temperatura sigue subiendo, el máximo de radiación continúa desplazándose hacia las longitudes de ondas cortas y cada vez se emite más luz visible de longitudes cada vez menores. Aunque el objeto radia más luz roja, se van agregando poco a poco luz anaranjada y luz amarilla en cantidades menores pero significativas. Al llegar a los 1.000°C la mezcla de colores la percibimos como naranja, y a los 2.000°C como amarilla. Lo cual no significa que a los 1.000°C sólo se radie luz naranja y a los 2.000°C sólo se radie luz amarilla, porque si fuese así, habría efectivamente que esperar que lo siguiente fuese “color verde”. Lo que en realidad vemos son mezclas de colores.

Al llegar a los 6.000°C (la temperatura superficial del Sol), el máximo de radiación está en el amarillo visible y lo que llega a nuestros ojos son grandes cantidades de luz visible, desde el violeta hasta el rojo. La incidencia simultánea de toda la gama de luz visible sobre nuestra retina nos da la sensación de blanco, y de ahí el color del Sol.
Los objetos más calientes aún que el Sol radian todas las longitudes de ondas de luz visible y en cantidades todavía mayores, pero el máximo de radiación se desplaza al azul, de modo que la mezcla se desequilibra y el blanco adquiere un tinte azulado.
Toda esta travesía se produce para objetos calientes que emiten “espectros continuos”, es decir, que radian luz en la forma de una ancha banda de longitudes de ondas. Ciertas sustancias en condiciones adecuadas, radian sólo luz de determinadas longitudes de onda. El nitrato de bario radia luz verde cuando se calienta, y con ese fin se lo utiliza en los fuegos de artificio, “calor verde”, podríamos decir.


Nitrato de Bario que produce el color verde en los bonitos fuegos artificiales
¡Qué bonito es saber!

En alguna ocasión todos hemos oído mencionar la palabra “gases nobles”, y sin embargo no siempre sabemos lo que son y el por qué le llaman así. Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan “inertes”. El nitrógeno y el platino son ejemplos de elementos inertes.
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química. Estos nuevos gases (helio, neón, argón, kripton, xenón y radón) son más inertes que cualquier otro elemento y se agrupan bajo el nombre de gases inertes.
Los elementos inertes reciben a veces el calificativo de “nobles” porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia. El oro y el platino son ejemplos de “metales nobles”, y por la misma razón se llaman a veces “gases nobles” a los gases inertes. Hasta 1.962, el nombre más común era el de gases inertes, quizá porque lo de nobles parecía poco apropiados en sociedades democráticas.

Es apropiado incluir una descripción de este grupo de elementos conocido en un capítulo dedicado a los halógenos, porque el flúor es el único elemento conocido que entra en combinación química directa con los dos gases nobles más pesados, el xenón y el criptón, resultando en compuestos estables.
Los gases nobles surgen en la naturaleza como constituyentes menos abundantes de la atmósfera. La primera indicación de la existencia de los gases nobles fue divulgada por el químico ingles Cavendish, en 1784.
La razón de que los gases inertes sean inertes es que el conjunto de electrones de cada uno de sus átomos está distribuido en capas especialmente estables. La más exterior, en concreto, tiene 8 electrones. Así la distribución electrónica del neón es (2,8) y la del argón (2,8,8). Como la adición o sustracción de electrones rompe esta distribución estable, no pueden producirse cambios electrónicos. Lo cual significa que no pueden producirse reacciones químicas y que estos elementos son inertes.
Ahora bien, el grado de inercia depende de la fuerza con que el núcleo, cargado positivamente y situado en el centro del átomo sujeta a los 8 electrones de la capa exterior. Cuantas más capas electrónicas haya entre la exterior y el centro, más débil será la atracción del núcleo central sobre los electrones de esa última capa de electrones.

El Radón es un gas radiactivo de origen natural procedente de la desintegración radiactiva de pequeñas cantidades de uranio presentes en rocas y suelo, es el responsable de miles de muertes por cáncer de pulmón en Europa cada año. El gas se filtra en los edificios a través del suelo y de los sótanos, puede acumularse llegando a niveles elevados, especialmente en espacios cerrados y poco ventilados.
Quiere esto decir que el gas inerte más complejo es también el menos inerte. El gas inerte de estructura atómica más complicada es el radón. Sus átomos tienen una distribución electrónica de (2,8,18,32,18,8). El radón, sin embargo está sólo constituido por isótopos radiactivos y es un elemento con el que difícilmente se pueden hacer experimentos químicos. El siguiente en orden de complejidad es el xenón, que es estable. Sus átomos tienen una distribución electrónica de (2,8,18,18,8).
Se sabe desde hace décadas que la abundancia en la Tierra del xenón es menor de lo que debería ser según las proporciones observadas del resto de gases nobles. Las abundancias de estos gases se usan por los geoquímicos para evaluar y datar los principales procesos terrestres, incluyendo la formación de la atmósfera. Para poder hacerlo parten de una hipótesis básica: que los gases nobles son inertes en toda circunstancia. Un trabajo realizado por Gary Schrobilgen y David Brock, de la Universidad McMaster (Canadá), cuyos resultados se publican en el Journal of the American Chemical Society explica la baja abundancia del xenón y pone en evidencia que el xenón no es tan noble como se suponía.
Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos. En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente. El átomo con mayor apetencia de electrones es el flúor, y así fue como en 1.962 el químico canadiense Neil Bartlett consiguió formar compuestos de xenón y flúor.
Desde entonces se han conseguido formar también compuestos de radón y kriptón. Por eso los químicos rehúyen el nombre de gases inertes, porque a fin de cuentas, esos gases no son completamente inertes. Hoy día se ha impuesto la denominación de “gases nobles”, y existe toda una rama de la química que se ocupa de los “compuestos de gases nobles”.

Naturalmente, cuanto más pequeño es el átomo de un gas noble, más inerte es, y no se ha encontrado nada que sea capaz de arrancarles algún electrón. El argón, cuya distribución electrónica es de 2,8,8 y el neón, con 2,8 electrones respectivamente, sigue siendo completamente inerte. Y el más inerte de todos es el helio, cuyos átomos contienen una sola capa electrónica con dos electrones (que es lo máximo que puede alojar esta primera capa) que al estar en la primera linea cerca del núcleo positivo, están fuertemente atraídos al tener su carga eléctrica el signo negativo.
Para finalizar diré que los gases nobles (gases inertes, gases raros) están clasificados en el grupo 18 (antiguamente 0) de la tabla periódica de dos elementos y se definen por símbolos que responden a: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn).

Ya se dijo antes la configuración electrónica de cada uno de ellos y todas las capas internas están completamente ocupadas, lo que hace que estos elementos, por tanto, constituyan la terminación de un periodo y posean configuración de capa completa, por lo que sus energías de ionización son muy elevadas y su reactividad química escasa.
Como son monoatómicos, las moléculas de los gases nobles poseen simetría esférica, y las fuerzas intermoleculares son muy débiles, por lo que sus entalpías de vaporización son muy bajas.
Con todo lo anteriormente expuesto sobre los gases nobles, espero que el lector del trabajo aquí reflejado pueda tener una idea más amplia y un conocimiento más certero sobre lo que en realidad son los denominados como “gases nobles”.
En comparación con la inmensidad del universo, nos queda aún muchísimo que aprender. Si nos limitamos a nuestro entorno más cercano, la Tierra, ¿cómo hemos podido llegar tan lejos?
¡La curiosidad! y ¡La necesidad! ¡El Instinto! y ¡La Evolución! Todo ello, amigos míos, nos lleva a querer saber y, para ello, debemos desvelar los secretos de la Naturaleza, como que, por cierto, no resulta nada fácil, llevamos miles de años intentando comprender y, de momento, sólo sabemos… ¡Algunas cosas!
emilio silvera
Feb
1
¡Ese fantásticio mundo…, de lo muy pequeño!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en ¡Partículas! ~
Clasificado en ¡Partículas! ~
 Comments (4)
Comments (4)

“Adentrarse en el universo de las partículas que componen los elementos de la tabla periódica, y en definitiva, la materia conocida, es verdaderamente fantástico”.
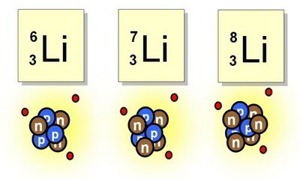
Tan pronto como los Joliot-Curie crearon el primer isótopo radiactivo artificial, los físicos se lanzaron en tropel a producir tribus enteras de ellas. En realidad, las variedades radiactivas de cada elemento en la tabla periódica son producto de laboratorio. En la moderna tabla periódica, cada elemento es una familia con miembros estables e inestables, algunos procedentes de la naturaleza, otros sólo del laboratorio. Por ejemplo, el hidrógeno presenta tres variedades: en primer lugar, el corriente, que tienen un solo protón. En 1932, el químico Harold Urey logró aislar el segundo. Lo consiguió sometiendo a lenta evaporación una gran cantidad de agua, de acuerdo con la teoría de que los residuos representarían una concentración de la forma más pesada del hidrógeno que se conocía, y, en efecto, cuando se examinaron al espectroscopio las últimas gotas de agua no evaporadas, se descubrió en el espectro una leve línea cuya posición matemática revelaba la presencia de hidrógeno pesado.

Cada día se avanza más en el conocimiento de los elemetos, y, el último descubierto ha sido el “Copernicium”, Este nuevo elemento de la tabla periódica, que clasifica los elementos en función de sus propiedades químicas, es 277 veces más pesado que el hidrógeno. De hecho, es el elemento más pesado oficialmente reconocido por la Unión Internacional de Química Pura y Aplicada (IUPAC)”, según el Centro de investigación de iones pesados (GSI) de Darmstadt (Alemania), que lo fabricó.
Pero sigamos: El núcleo de hidrógeno pesado está constituido por un protón y un neutrón. Como tiene un número másico de 2, el isótopo es hidrógeno. Urey llamó a este átomo deuterio (de la voz griega deutoros, “segundo”), y el núcleo deuterón. Una molécula de agua que contenga deuterio se denomina agua pesada, que tiene puntos de ebullición y congelación superiores al agua ordinaria, ya que la masa del deuterio es dos veces mayor que la del hidrógeno corriente. Mientras que ésta hierve a 100º C y se congela a 0º C, el agua pesada hierve a 101’42º C y se congela a 3’79º C. El punto de ebullición del deuterio es de -23’7º K, frente a los 20’4º K del hidrógeno corriente. El deuterio se presenta en la naturaleza en la proporción de una parte por cada 6.000 partes de hidrógeno corriente. En 1934 se otorgó a Urey el premio Nobel de Química por su descubrimiento del deuterio. El deuterio resultó ser una partícula muy valiosa para bombardear los núcleos. En 1934, el físico australiano Marcus Lawrence Edwin Oliphant y el austriaco P. Harteck atacaron el deuterio con deuterones y produjeron una tercera forma de hidrógeno, constituido por un protón y dos neutrones. La reacción se planteó así:
El deuterio resultó ser una partícula muy valiosa para bombardear los núcleos. En 1934, el físico australiano Marcus Lawrence Edwin Oliphant y el austriaco P. Harteck atacaron el deuterio con deuterones y produjeron una tercera forma de hidrógeno, constituido por un protón y dos neutrones. La reacción se planteó así:

Los tres isótopos del hidrógeno. El protio y el deuterio son estables, pero el tritio no: uno de sus neutrones emite pronto una partícula beta y se convierte en un protón, dando lugar al helio-3 (2 protones, 1 neutrón). El hidrógeno-4, aunque existe, es en extremo inestable y pierde rápidamente su tercer neutrón para convertirse de nuevo en tritio.
hidrógeno 2 + hidrógeno 2 = hidrógeno 3 + hidrógeno 1
Este nuevo hidrógeno superpesado se denominó tritio (del griego tritos, “tercero”); su ebullición a 25º K y su fusión a 20’5º K.
Todo gira en el Universo, desde las partículas hasta los mundos, las estrellas y las galaxias que forman supercúmulos que también giran. El Universo es dinámico, todo en él tiene un movimiento un ritmo que está marcado por las leyes fundamentales de la naturaleza.

Como es mi costumbre, me desvío del tema y sin poderlo evitar, mis ideas (que parecen tener vida propia), cogen los caminos más diversos. Basta con que se cruce en el camino del trabajo que realizo un fugaz recuerdo; lo sigo y me lleva a destinos distintos de los que me propuse al comenzar. Así, en este caso, me pasé a la química, que también me gusta mucho y está directamente relacionada con la física; de hecho son hermanas: la madre, las matemáticas, la única que finalmente lo podrá explicar todo.

Fotografía del espín atómico por primera vez conseguido
Estamos hablando de las partículas y no podemos dejar a un lado el tema del movimiento rotatorio de las mismas. Usualmente se ve cómo la partícula gira sobre su eje, a semejanza de un trompo, o como la Tierra o el Sol, o nuestra galaxia o, si se me permite decirlo, como el propio universo. En 1925, los físicos holandeses George Eugene Uhlenbeck y Samuel Abraham Goudsmit aludieron por primera vez a esa rotación de las partículas. Éstas, al girar, generan un minúsculo campo electromagnético; tales campos han sido objeto de medidas y exploraciones, principalmente por parte del físico alemán Otto Stern y el físico norteamericano Isaac Rabi, quienes recibieron los premios Nobel de Física en 1943 y 1944 respectivamente, por sus trabajos sobre dicho fenómeno.

Estadística Fermi-Dirac para las Fermiones
Esas partículas (al igual que el protón, el neutrón y el electrón), que poseen espines que pueden medirse en números mitad, se consideran según un sistema de reglas elaboradas independientemente, en 1926, por Fermi y Dirac; por ello, se las llama y conoce como estadísticas Fermi-dirac. Las partículas que obedecen a las mismas se denominan fermiones, por lo cual el protón, el electrón y el neutrón son todos fermiones.
Estadística Bose-Einstein para los Bosones
Hay también partículas cuya rotación, al duplicarse, resulta igual a un número par. Para manipular sus energías hay otra serie de reglas, ideadas por Einstein y el físico indio S. N. Bose. Las partículas que se adaptan a la estadística Bose-Einstein son bosones, como por ejemplo la partícula alfa.
Las reglas de la mecánica cuántica tienen que ser aplicadas si queremos describir estadísticamente un sistema de partículas que obedece a reglas de esta teoría en vez de los de la mecánica clásica. En estadística cuántica, los estados de energía se considera que están cuantizados. La estadística de Bose-Einstein se aplica si cualquier número de partículas puede ocupar un estado cuántico dado. Dichas partículas (como dije antes) son bosones, que tienden a juntarse.
Los bosones tienen un momento angular nh/2π, donde n es cero o un entero, y h es la constante de Planck. Para bosones idénticos, la función de ondas es siempre simétrica. Si sólo una partícula puede ocupar un estado cuántico, tenemos que aplicar la estadística Fermi-Dirac y las partículas (como también antes dije) son los fermiones que tienen momento angular (n + ½)h / 2π y cualquier función de ondas de fermiones idénticos es siempre antisimétrica. La relación entre el espín y la estadística de las partículas está demostrada por el teorema espín-estadística.
En un espacio de dos dimensiones es posible que haya partículas (o cuasipartículas) con estadística intermedia entre bosones y fermiones. Estas partículas se conocen con el nombre de aniones; para aniones idénticos, la función de ondas no es simétrica (un cambio de fase de +1) o antisimétrica (un cambio de fase de -1), sino que interpola continuamente entre +1 y -1. Los aniones pueden ser importantes en el análisis del efecto Hall cuántico fraccional y han sido sugeridos como un mecanismo para la superconductividad de alta temperatura.
Debido al principio de exclusión de Pauli, es imposible que dos fermiones ocupen el mismo estado cuántico (al contrario de lo que ocurre con los bosones). La condensación Bose-Einstein es de importancia fundamental para explicar el fenómeno de la superfluidez. A temperaturas muy bajas (del orden de 2×10-7 K) se puede formar un condensado de Bose-Einstein, en el que varios miles de átomos dorman una única entidad (un superátomo). Este efecto ha sido observado con átomos de rubidio y litio. Como ha habréis podido suponer, la condensación Bose-Einstein es llamada así en honor al físico Satyendra Nath Bose (1894 – 1974) y a Albert Einstein. Así que, el principio de exclusión de Pauli tiene aplicación no sólo a los electrones, sino también a los fermiones; pero no a los bosones.

Si nos fijamos en todo lo que estamos hablando aquí, es fácil comprender cómo forma un campo magnético la partícula cargada que gira, pero ya no resulta tan fácil saber por qué ha de hacer lo mismo un neutrón descargado. Lo cierto es que cuando un rayo de neutrones incide sobre un hierro magnetizado, no se comporta de la misma forma que lo haría si el hierro no estuviese magnetizado. El magnetismo del neutrón sigue siendo un misterio; los físicos sospechan que contiene cargas positivas y negativas equivalente a cero, aunque por alguna razón desconocida, logran crear un campo magnético cuando gira la partícula.
Particularmente creo que, si el neutrón tiene masa, si la masa es energía (E = mc2), y si la energía es electricidad y magnetismo (según Maxwell), el magnetismo del neutrón no es tan extraño, sino que es un aspecto de lo que en realidad es materia. La materia es la luz, la energía, el magnetismo, en definitiva, la fuerza que reina en el universo y que está presente de una u otra forma en todas partes (aunque no podamos verla).
Así, los fermiones están asociados con la idea que tenemos de materia. Obedecen la estadística de Fermi-Dirac. Cumplen el principio de exclusión de Pauli (dos fermiones no pueden ocupar el mismo estado cuántico a la vez). Tienen espín semientero. Cada fermión posee su propio anti-fermión. Hay 12 fermiones diferentes: 6 son quarks y 6 son leptones. Los fermiones se agrupan en tres familias o tres generaciones: cada uno consistente en una pareja de quarks y una pareja de leptones.
Tres quarks forman un protón, que es un nucleón y también un fermión. Los quarks son portadores de carga de color y por ello interaccionan con la llamada fuerza fuerte. También poseen carga eléctrica e isospín débil, por lo que también interaccionan con la fuerza electromagnética y la fuerza débil. Hay 6 tipos de quarks llamados up, down, charm, strange, top and bottom (o beauty).
La fuerza fuerte les confina de forma que se encuentran siempre agrupados formando compuestos sin carga de color: los hadrones. Éstos pueden estar constituidos por 3 quarks (y se llaman entonces bariones) o por una pareja de quark y antiquark (los mesones, que en realidad son bosones). Nuestros bien conocidos protones y neutrones son un tipo de bariones, y están por tanto compuestos por 3 quarks.
Familias de quarks, leptones y partíuclas de fuerza (bosones) que rigen el universo de la materia.
Los leptones no tienen carga de color, por lo que no interaccionan con la fuerza fuerte. A este grupo pertenecen el electrón, el muón y el tau, además de los neutrinos que cada uno lleva asociado, el neutrino electrónico, el muónico y el tauónico.
El electrón, el muón y el tau tienen carga eléctrica e interaccionan con la fuerza electromagnética y la fuerza débil. Los neutrinos no tienen carga eléctrica, por lo que sólo interaccionan con la fuerza débil, una de las razones por las que son difíciles de detectar.
Entre los bosones gauge encontramos a los fotones (portadores de la fuerza electromagnética), los gluones (portadores de la fuerza fuerte) y los bosones W+, W- y Z (portadores de la fuerza débil).

El Bosón de Higgs no sabemos… todavía, que pelaje tendrá
Además está teorizada la existencia del bosón de Higgs (de espín cero), que es una partícula elemental que explicaría el origen de la masa de las partículas elementales. Es la única partícula del Modelo Estándar de la que no hay todavía evidencia experimental. El gran colisionador de hadrones (LHC) del CERN espera descubrir pronto a este escurridizo bosón.
Hadrón, leptón, muón, barión, fermión …. ¡Vaya lío!. No te desanimes con tan variada fauna, sólo quería presentarte a sus principales componentes, así podrás identificarlos en sus grupos cuando oigas hablar de ellos y hacerte una idea de sus propiedades y de cómo interaccionan. Escucharás muchos más nombres raros llamados con letras griegas (lambda, sigma, delta …), no te alarmes, muy probablemente serán tipos de hadrones.
Quédate con esto:
“Por lo que conocemos hasta ahora, los ladrillos fundamentales de nuestro universo son los quarks, los leptones y los bosones portadores de fuerza.”
Puede que, con las explicaciones aquí dadas, alguien haya podido alcanzar una mejor comprensiòn de todo este fantástico mundillo de las partículas subatómicas que, como se dice más arriba, son los componentes más fundamentales del Universo y de lo que todo, lo que conocemos, está hecho. También nosotros.
Pensándolo bienn… ¡Qué imaginación tiene la Naturaleza!
emilio silvera
Feb
1
¡Los pensamientos! ¿Quién nos los puede quitar?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El Universo y los pensamientos ~
Clasificado en El Universo y los pensamientos ~
 Comments (3)
Comments (3)
Los procesos científicos que comentamos en este lugar, los fenómenos del Universo que hemos debatido y, también, los misterios y secretos que el inmenso Cosmos nos oculta han contribuido, aunque inadvertidamente, a comprometer e involucrar a nuestra especie en la vastedad del universo. La astronomía ha venido a descorrer el velo, que supuestamente, aislaban la Tierra de los ámbitos etéreos que están situados mucho más allá de la Lunase hallan, todo eso, nos llevó lejos al auténtico Universo que ahora, sí conocemos. La Física cuántica llegó para destruir esa barrera invisible que separaba lo grande de lo muy pequeño y que supuestamente, separaba al observador distante del mundo observado; descubrimos que estamos inevitablemente enredados en aquello que estudiamos.
La Astrofísica, al demostrar que la materia es la misma en todas partes y que en todas partes obedece a las mismas leyes, reveló una unidad cósmica que se extiende desde la fusión nuclear en las estrellas hasta la química de la vida que allí se produce a lo largo de todo el Universo. La evolución darwiniana, al destacar que todas las especies de la vida terrestre están relacionadas y que todas surgieron de la materia ordinaria, puso de manifiesto que no hay ninguna muralla que nos separe de las otras criaturas de la Tierra, o del planeta que nos dio la vida: que estamos hechos del mismo material del que están hechos los mundos.
Bio-moléculas, precursoras de la vida en el espacio
La convicción de que, en cierto sentido, formamos una unidad con el universo, por supuesto, ha sido afirmada antes muchas veces, en otras esferas de pensamiento. Hahvé creó a Adán del polvo; el griego Heráclito escribió que “todas las cosas son una sola”; Lao-tse, en China, describió al hombre y la naturaleza como gobernados por un solo principio (“lo llamó el Tao”); y la creencia en la unidad de la Humanidad con el cosmos estaba difundida entre los pueblos anteriores a la escritura, como lo puso de relieve el jefe indio suquamish Seattle, quien declaró en su lecho de muerte que, “todas las cosas están conectadas, como la sangre que une a una misma familia. Todo es como una misma familia, os lo digo”.

La física sugiera que la vida, pudiera ser un fenómeno cuántico antes que biológico
Pero hay algo sorprendente en el hecho de que la misma concepción general ha surgido de ciencias que se enorgullecen de su lúcida búsqueda de hechos objetivos, empíricos. Desde los mapas de cromosomas y los registros fósiles que representan las interconexiones de todos los seres vivos de la Tierra, hasta la semejanza de las proporciones químicas cósmicas con las de las especies vivas terrestres, nos muestran que realmente formamos parte del universo en su conjunto.
La verificación científica de nuestra participación en las acciones del cosmos tiene, desde luego, muchas implicaciones. Una de ellas es, si la vida inteligente ha evolucionado en este planeta, también puede haberlo hecho en otras partes. La Teoría de la evolución de Darwin, aunque no explica el antiguo enigma de por qué existe la vida, deja claro que la vida puede surgir de la materia ordinaria y evolucionar hasta una forma “inteligente”, al menos en un planeta como la Tierra que gira alredeedor de una estrella como el Sol (más de dioez mil millones en la Vía Láctea solamente) y, presumiblemente, más que unos pocos planetas semejantes a la Tierra, podemos especular que no somos la única especie que ha estudiado el universo y se ha preguntado sobre su papel en él.


Nuestra comprensión de la relación entre la Mente el el Universo puede depender de que podamos tomar contacto con otra especie inteligente con la cual compararnos. Raramente la ciencia ha obtenido buenos resultados al estudiar fenómenos de los que sólo tenía un ejemplo: Las leyes de Newton y Einstein habrían sido mucho más difíciles -quizá imposibles- de fortmular si sólo hubiese habido un planeta para someterlas a prueba, y a menudo se dice que el problema de la cosmología es que sólo tenemos un universo para examinar. (El descubrimiento de la evolucoión cósmica reduce un poco esta dificultad al ofrecer a nuestra consideración el estado muy diferente del universo en los primeros momentos de la evolución cósmica.) La cuestión de la vida estraterrestre, pues, va más allá de problemas como el de si estamos solos en el universo, o si podemos esperar tener compañia cósmica o si debemos temer invasiones exteriores; también es un modo de examinarnos a nosotros mismos y nuestra relación con el resto de la Naturaleza.



¿Quién sabe lo que nos podemos encontrar ahí fuera? Sabemos que las moléculas biológicas de la vida están en las Nebulosas, y, también sabemos que existen muchos mundos que, como la propia Tierra, pueden albergar formas de vida de tan rica diversidad como, la Naturaleza, es capaz de producir.
Aunque mucho de esto es nuevo, el interés reciente por la vida estraterrestre puede considerarse como un resultasdo del último vuelco en la fortuna del materialismo, la doctrina filosófica según la cual es posible explicar los sucesos exclusivamente en términos de interacciones materiales, sin recurrir a conceptos insustanciales tales como el espíritu. El darwinismo engendró una nueva actitud de respeto hacia las potencialidades de la materia ordinaria:
“Un montón de barro en un charco de agua de lluvia empieza a parecer mágico, si se piensa que sus iguales de antaño lograron elevarse hasta dar origen a todo el conjunto de la vida terrestre, inclusive la del individuo que contempla el barro.”

Una persona reflexiva, recordando que su ascendencia se remonta, a través de los mamíferos, hasta los peces, los aminoácidos, los azúcares de la materia prebiótica, no puede estar de acuerdo con Martín Lutero en que la Tierra es “sucia” y “nociva”, o aceptar el veredicto de la Christia Sciencie de que “no hay vida, verdad, sustancia ni inteligencia en la materia”.
En realidad -al menos eso creo-, la materia tiene memoria y está predeterminada para lo que tiene que hacer, sigue lo que le dicta la Naturaleza que la lleva, de manera irremediable…, hacia la vida.
Históricamente, los materialistas se han inclinado a pensar que hay vida en otros mundos. El atomista Metrodoro escribió en el siglo IV a. de C. que:

“Considerar la Tierra como el único mundo poblado en el espacio infinito es tan absurdo como afirmar que en todo un campo sembrado de mijo sólo un grano crecerá”.
Cinco siglos más tarde, el epicuréo Lucrecio sostuvo que “hay infinitos mundos iguales y diferentes de este mundo nuestro”. La Iglesia católica romana, convencida de que los seres humanos son esencialmente espíritus inmateriales, se sintió amenazada por el punto de vista materialista: cuando Giordiano Bruno, el decano renacentista del misticismo popular, afirmaba que la materia “es en verdad toda la naturaleza y la madre de todo lo vivo, y declaró que Dios “es glorificado, no en uno, sino en incontables soles; no es una sola Tierra, sino en mil, que digo, en infinidad de mundos”, fue atado a una estaca de hierro y quemado vivo, el 19 de febrero de 1600, en la Piazza Campo dei Fiori de Roma.
Sin embargo, cuando la ciencia creció también lo hizo el materialismo, y con él la creencia de una pluralidad de mundos. Podríamos seguir por este camino y filosofar sobre lo que fue, lo que es y, lo que probablemente será pero, el tiempo se me acaba y, desde luego, no quisiera cerrar este trabajo sin dejar una falsa sensación.
La Ciencia está muy bien, el materialismo viene a poner nuestros pies en el suelo y hacer que nos fijemos en las cosas tal como son o, al menos, tal como creemos que son. Sin embargo, una cuestión me tiene desconcertado: ¿Cómo podemos sentir en la forma que sentimos? ¿De donde vienen esos sentimientos? ¿Será quizá una muestra suprema de la evolución del mundo material? ¿Tendrá memoria la materia?
Por si acaso, yo dejaría aquí un gran signo de interrogación, ya que, hemos alcanzado una pequeña cota de la altísima montaña que nos hemos propuesta escalar, y, desde luego, no sabemos lo que nos podremos encontrar cuando lleguemos a cotas más elevadas, ya que, pensar en llegar al final…no parece nada fácil.
Una cosa sí que está clara para mí:
¡Que hay mucha vida en el Universo y que, la única libertad que tenemos…, son nuestros pensamientos!
La primera tenemos que demostrarla y, la segunda, simplemente con mirar la Historia…, hallaremos la respuesta.
emilio silvera















 Totales: 67.083.518
Totales: 67.083.518 Conectados: 27
Conectados: 27